Tilfælde: En 73-årig mand med en historie med hypertension, koronararteriesygdom og tidligere myokardie infarkt (MI) præsenteres for akutafdelingen (ED) med træthed, åndenød, nedsat urinproduktion og hævelse af anklene. Ved ankomsten inkluderer hans vitale tegn BP 87/58 mm Hg, HR 102, RR 24, T-mætning 86% på rumluft og temperatur 98,2 F, og han har knitrende på auskultation. Hvordan ville du håndtere denne patient?
Hvad er kardiogent chok?
Selvom definitionerne varierer, er kardiogent chok (CS) en klinisk diagnose, der bredt defineres som en tilstand med lavt cardiac output med tilhørende utilstrækkelig slutorgan-perfusion eller vævshypoperfusion sekundært til hjerteskader. 1 Almindeligt anvendte kriterier afledt af SHOCK-forsøget består af hypotension (SBP < 90mmHg eller > 90mmHg med understøttende pleje), bevis for slut- organhypoperfusion og hjerteindeks (CI) < 2,2 L / min / m2 eller pulmonalt kapillært kiletryk ≥ 15 mmHg 2,3 Selvom denne definition er nyttig til at standardisere inklusionskriterier til kliniske forsøg , det er mindre værdifuldt til diagnosticering af CS i akutafdelingen (ED). Ved skift i en travl ED kan CS være udfordrende at diagnosticere på grund af de forskellige præsentationer, overlapning med andre choktilstande (dvs. sepsis), dårligt forstået patofysiologi, komplekse og multifaktorielle årsager og varierede hæmodynamiske parametre.4 I fravær af invasiv hjerteoutput (CO) og PCWP-værdier, kan CS udledes ved hjælp af tegn på forhøjede påfyldningstryk (dvs. lungestop eller forhøjet JVP), kliniske tegn på hypoperfusion og en historie og ekko, der tyder på hjertesvigt. Dødelighed sekundært til CS er høj (~ 25-70%), men tidlig anerkendelse og intervention forbedrer overlevelsen.4,5 Nødlæger har mulighed for at diagnosticere CS ved indlæggelse og skal opretholde en høj klinisk mistanke, når de ser en kritisk syg patient. Denne gennemgang vil fokusere på genkendelse og tip til, hvordan man ikke går glip af diagnosen CS gennem fysisk undersøgelse, laboratorier, ultralyd ved sengen og billeddannelse.
Hvad er årsagerne til kardiogent shock?
De fleste studier af CS fokuserer på patienter med CS sekundært til myokardieinfarkt (MI), der involverer venstre ventrikel. Selvom MI er den primære årsag til CS (~ 70%), skal enhver årsag til ventrikulær dysfunktion og reduceret CO eller hjerteindeks (CO / legemsoverfladeareal) som en potentiel årsag overvejes.6 Dette inkluderer, men er ikke begrænset til, ikke-iskæmiske årsager til højre hjertesvigt, myokarditis, takotsubo-kardiomyopati, hypertrofisk kardiomyopati eller valvulær hjertesygdom (tabel 1). For at gøre tingene mere udfordrende er CS et kontinuum snarere end en statisk tilstand, der spænder fra forværret hjertesvigt til ildfast chok med irreversibel organskade (figur 1). CS bliver endnu mere variabel med forekomsten af sekundære fornærmelser såsom arytmier eller progressiv iskæmi og acidose.3 Det skal bemærkes, at i 2/3 af tilfældene er CS ikke til stede ved indlæggelse, men udvikler sig senere inden for 48 timer efter indlæggelse som patient skrider frem gennem chokkontinuumet.7 Det er vigtigt ofte at revurdere patienters vitale tegn, symptomer, fysisk undersøgelse og ekko ved sengen.

Tabel 1: Årsager til CS, tilpasset Parrillo & Dellinger (2013). 8 70% af CS-tilfælde er forårsaget af akutte MI’er.6 Effekter af akut MI med tilhørende procentdele taget fra resultaterne af SHOCK-prøveregistret.9.10
Figur 1: Kontinuum af CS, tilpasset fra Bellumkonda et al. . (2018) .3 Dette spektrum kan afvige med sekundære fornærmelser (f.eks. Nye arytmier).
Dødelighed i kardiogent shock
Selvom dødelighed sekundær til CS forbliver høj, er 4 tidlige genkendelser og interventioner forbedrer overlevelse.5 Brug af data, der omfattede SHOCK-forsøgsregistret, 30-dages dødelighed på hospitalet af 1.217 patienter, der blev diagnosticeret med CS sekundær til venstre hjertekammer (LV) eller højre hjertekammer (RV) svigt på grund af en akut MI var 57% . Hvis du tager flere risikofaktorer i betragtning, specifikt chok ved indlæggelse, alder, tidligere koronar bypass-grafting (CABG), noninferior MI, kreatinin > 1,9 mg / dL, nedsat SBP, anoxisk hjerneskade og kliniske beviser for slutorganers hypoperfusion, kunne patienter opdeles med dødelighed fra 12% til 88% .11 I GRACE-forsøget faldt CS svagt, men signifikant mellem 1999 og 2006, sandsynligvis på grund af den øgede brug af perkutan koronar intervention (PCI), en vigtig form for tidlig intervention for patienter med MI kompliceret af CS.12 Selv ved stratificering af patienter baseret på risikofaktorer, var PCI og CABG til gavn for både patienter med lav og høj risiko.11 Tidlig diagnose og passende behandling forbliver, især i tilfælde af myokardieiskæmi, en vigtig, modificerbar bidragsyder til resultaterne for patienter med CS.
Desuden vil jo længere sandsynligheden for CS være, jo mere sandsynligt vil der være en maladaptiv inflammatorisk respons sekundært til en stigning i cytokiner som TNF-alfa og IL-6, som hæmmer hjerteaktivitet. 4,13 Der er også en stigning i vasopressin og angiotensin II, som øger efterbelastning, forværrer CO og øger vand- og saltretention og derved forårsager lungeødem. Nitrogenoxid (NO) øges også ved aktivering af NO-syntase, hvilket fører til vasodilatation og myokardial depression. Alle disse maladaptive reaktioner på lav CO og myokardieiskæmi fører til forværring af hjertevævsskade, deprimeret CO og distribuerende chok. Det skal bemærkes, at nogle tilfælde af CS er iatrogene, når patienter på randen af hjertesvigt behandles med aggressive diuretika, nitrater, betablokkere, ACEI og morfin. 14 Som den første læge, der evaluerer patienter, skal akutte læger derfor identificere og behandle CS på en tidsfølsom og klinisk passende måde.
Klinisk evaluering
Klassisk, patienter med CS til stede med klager over dyspnø, brystsmerter, træthed og / eller hævelse i anklene.15 Fysisk undersøgelse kan afsløre tegn på overbelastning, inklusive perifert ødem, jugular venøs distension (JVD), knitrende / rales ved auskultation og tegn på hypoperfusion såsom cool, dårligt perfunderede ekstremiteter (tabel 2). I en lille retrospektiv gennemgang af 30 patienter i udifferentieret chok var de med CS mere tilbøjelige til at have JVD (80% sammenlignet med 0% og 20%), kold hud (57,1% sammenlignet med 14,3% og. 28,5%) og lunge rales (75% versus 16,7% og 8,3%) sammenlignet med patienter med henholdsvis distributivt og hypovolemisk chok.16 I en anden prospektiv undersøgelse med 68 patienter brugte beboerne specifikke kliniske undersøgelsesresultater til at differentiere kategorier af chok. CS blev kategoriseret af SBP mindre end 90, tegn på lav output (kolde hænder, dårlig kapillærpåfyldning og svag puls), forhøjet jugulært venetryk (JVP) > 7 cmH2O, S3 galop og knitrer til 1/3 af lungerne. Ud af 68 patienter opfyldte 11 kriterier for CS. Hos patienter med ekkokardiografisk tegn på lavt hjerteudbytte forudsagde forhøjet JVP CS med en nøjagtighed på 80%, hvilket var uændret ved tilføjelse af tilstedeværelsen af knitrende.17
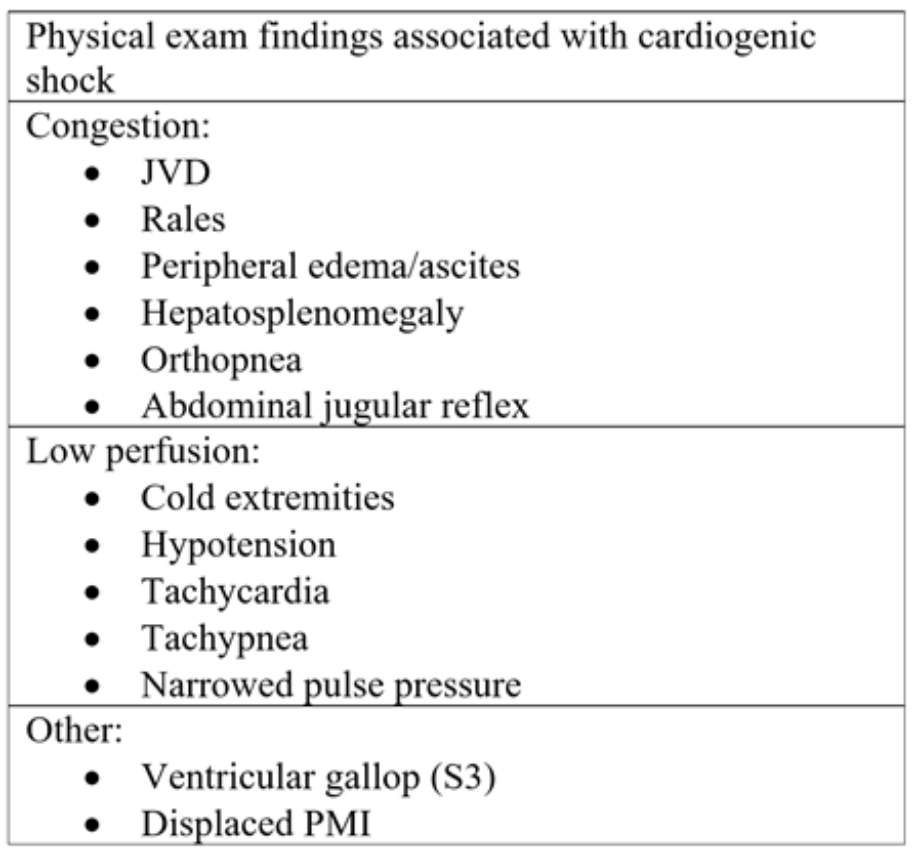
Tabel 2: Fysiske undersøgelseskomponenter set ved akut hjertesvigt og efterfølgende kardiogent shock.18
Selvom JVP er en nyttig proxy til forhøjet kiltryk, 19 kan det være svært at vurdere på grund af patientens kropsvaner og placeringen (sengens hoved skal være forhøjet 45 grader, hvilket kan være vanskeligt hos patienter med svær ortopnea). 20 JVP måles ved at beregne det højeste pulsationspunkt i cm over brystvinkel og derefter tilføje 5 (da højre atrium er 5 cm under brystvinklen), som korrelerer med distension i cmH20 (figur 2). Forhøjede værdier betragtes ofte som større end 6-8 cmH20.18 Bemærk, at forhøjet JVP er forbundet med øget risiko for dødelighed med en relativ risiko (RR) på 1.52.18
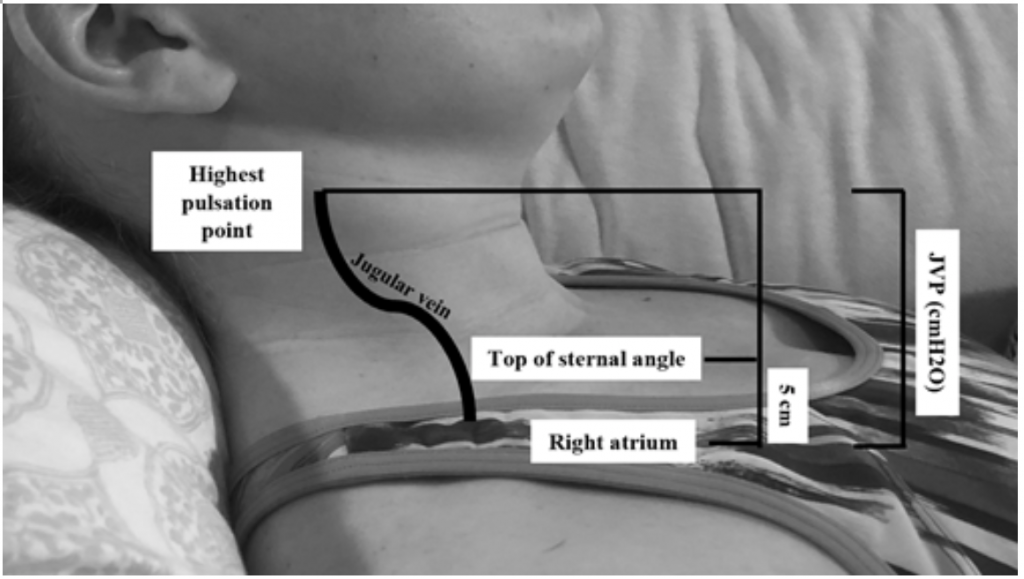
Figur 2: Måling af JVP, tilpasset fra Shah & Cowger (2014) .18
Labs kan vise en metabolisk acidose (efterhånden som lactat øges på grund af perifer iskæmi), nyrehypoperfusion med deraf følgende akut nyreskade og mulige tegn på hjerte-iskæmi med forhøjede troponin- og EKG-ændringer.15 I CardShock-undersøgelsen blev en multicenter, prospektiv, observationsundersøgelse af 219 CS patienter, var lactatniveauer signifikant associeret med øget mortalitet (justeret oddsforhold på 1,4) .6 Det er vigtigt at bemærke, at forhøjelse af lactat ikke er specifik for sepsis og kan ses i enhver hypoperfuseret tilstand, såsom CS.
På den anden side holder disse fysiske undersøgelsesresultater og hæmodynamiske parametre ikke altid sig. I en undersøgelse, der anvendte SHOCK Trial-registret, havde 5,2% af CS-patienterne ikke åbenbar hypotension, selvom de havde tegn på perifer hypoperfusion og lav CI.21 Dette skyldes sandsynligvis en adaptiv frigivelse af catecholamin i tidlig CS, hvilket øger systemisk vaskulær resistens ( SVR) og opretholder kortvarigt blodtryk, dog generelt med et snævert pulstryk.22 Selv patienter med klinisk signifikant lungeødem ved billeddannelse kan præsentere med hvæsende vejrtrækning eller endog klare lungelyde snarere end rales.23 I en undersøgelse blev lungestop kun set i ca. 2/3 tilfælde af CS sekundært til MI.21 Endvidere, selv med nedsat LV-kontraktilitet, har CS-patienter muligvis ikke en alvorlig reduktion i LVEF. 14,24 Faktisk er den gennemsnitlige EF i en kohorte af CS-patienter ca. 30%, hvilket er reduceret, men højere end forventet.2
Selvom undersøgelsen ikke er perfekt, kan en detaljeret fysisk undersøgelse, der søger tegn på overbelastning og perifer hypoperfusion sammen med en omhyggelig gennemgang af vitale tegn og laboratorier, være det første tip, din patient har kardiogent shock.
Point of care ECHO til evaluering af kardiogent shock
Når patienter præsenteres for ED hypotensiv eller hypoperfuseret, er RUSH-undersøgelsen en hurtig måde at differentiere chok ved at se på “pumpen, tanken og rørene. ” Estimering af ejektionsfraktion (EF) og CO (som CO = slagvolumen (SV) x hjertefrekvens (HR)) gennem simpelthen “øjenkugling” LV-klemme er en tilstrækkelig vurdering af læger i den akutte indstilling.27 I CS er den ringere vena cava (IVC), som er en indirekte måling af effektiv intra vaskulært volumen, skal have en diameter på > 2 cm i diameter og kollapser mindre end 50% med inspiration. Disse fund korrelerer med et forhøjet centralt venetryk.28 IVC-vurderingen kan imidlertid være unøjagtig, hvis patienten allerede har modtaget vasodilatatorer, diuretika og / eller er ventileret.29 Thoraxvinduer viser sandsynligvis lungeødem i form af overdreven B linjer (“lungeraketter”), der er resultatet af septalfortykning fra akkumulering af vand i interstitiumet. 30 Sammen med lungestop kan der være pleural og peritoneal væske ved RUSH-undersøgelse.25 I en metaanalyse, der anvendte data fra tre originale papirer og to sagsrapporter blev RUSH-protokollen vist at være både følsom og specifik (henholdsvis 0,89 og 0,97) i diagnosen CS.31 På trods af et højt resulterende positivt sandsynlighedsforhold (LR) på 22,29 var der kun en moderat negativ LR på 0,17, hvilket antyder, at RUSH-eksamen ikke er den perfekte test til at udelukke CS. Derfor bør RUSH-eksamen bruges i sammenhæng med en omhyggelig historie og fysisk undersøgelse snarere end at blive brugt alene til at diagnosticere cardiogeni c shock.
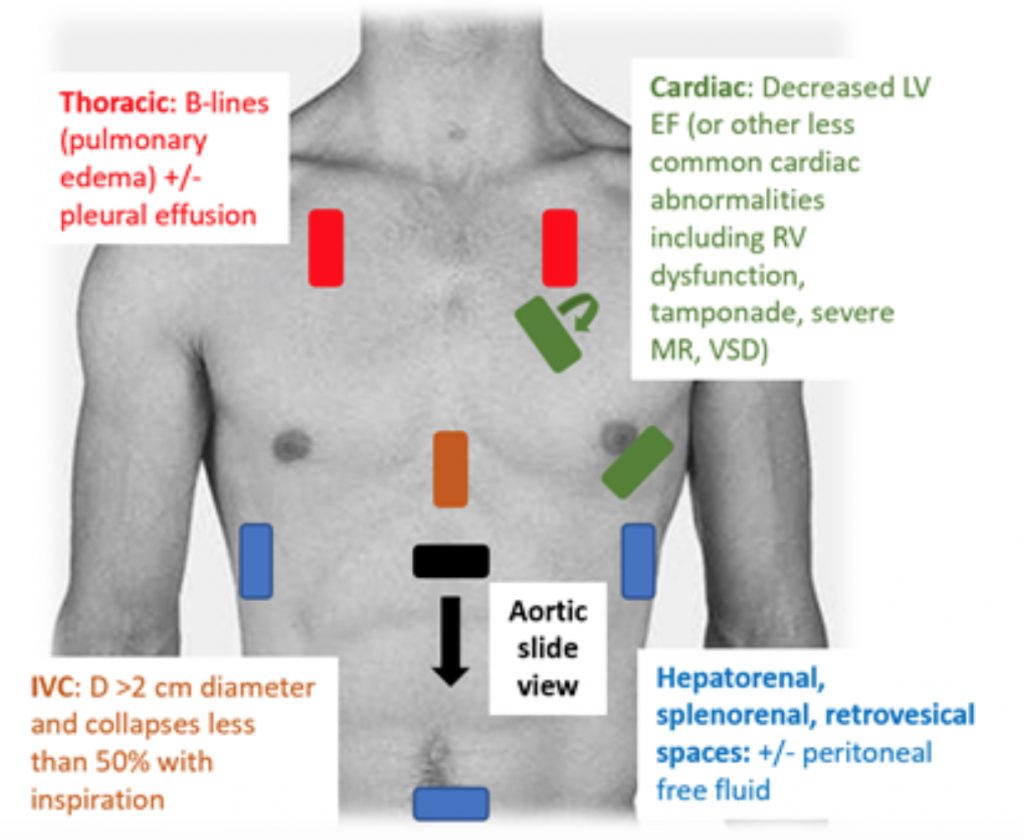
Figur 3: RUSH sengebordsundersøgelse i USA til evaluering af udifferentieret hypotension med tilhørende fund, der tyder på CS.25 , 26,29,30
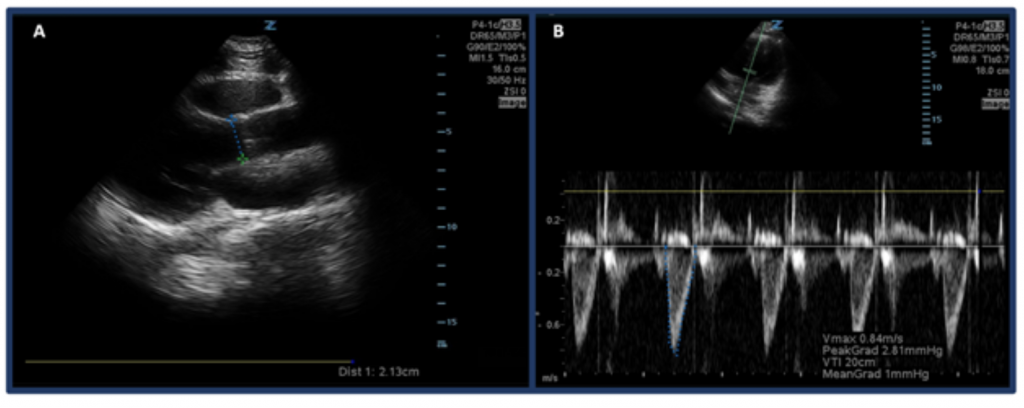
I stedet for blot at estimere CO gennem “øjenkugling” er en måde at måle CO med ultralyd på først at bestemme SV ved hjælp af venstre ventrikulær udstrømningskanal hastighed tidsinterval (LVOT VTI, eller hastighederne blodstrøm ved aortaudstrømningskanalen) og LVOT-diameter. Specifikt beregnes SV eller mængden af blod, der udstødes gennem venstre ventrikel pr. Beat, ved hjælp af LVOT VTI × tværsnitsareal af LVOT .32 For at måle LVOT-diameter skal du placere den trinvise array-probe i den parasternale langakse og måle afstand af LVOT lige over aortaklappen, mens den er i midten af systolen. VTI måles i apikal-5-kammeret. Ved hjælp af doppler-tilstand med pulserende bølge placeres dopplerbølgen lige over aortaklappen, og dopplerbølgeformer registreres. Sørg for at stille aksen på linje med udstrømningskanalen bedst muligt for at undgå over / under estimeringer. Efter at have valgt “LVOT VTI” måleværktøj, måles bølgeformen for en udkastningsperiode. 33,34 Normal LVOT VTI spænder fra 18-22 cm, skønt muligvis lavere med HR’er > 95 bpm. 35 Hos patienter med atrieflimren vil VTI-målinger sandsynligvis være en undervurdering af den sande værdi, og derfor foreslås et gennemsnit på 3-5 på hinanden følgende bølgeformer. Som man kunne forvente, er der en sammenhæng mellem lav LVOT VTI og uønskede resultater.32
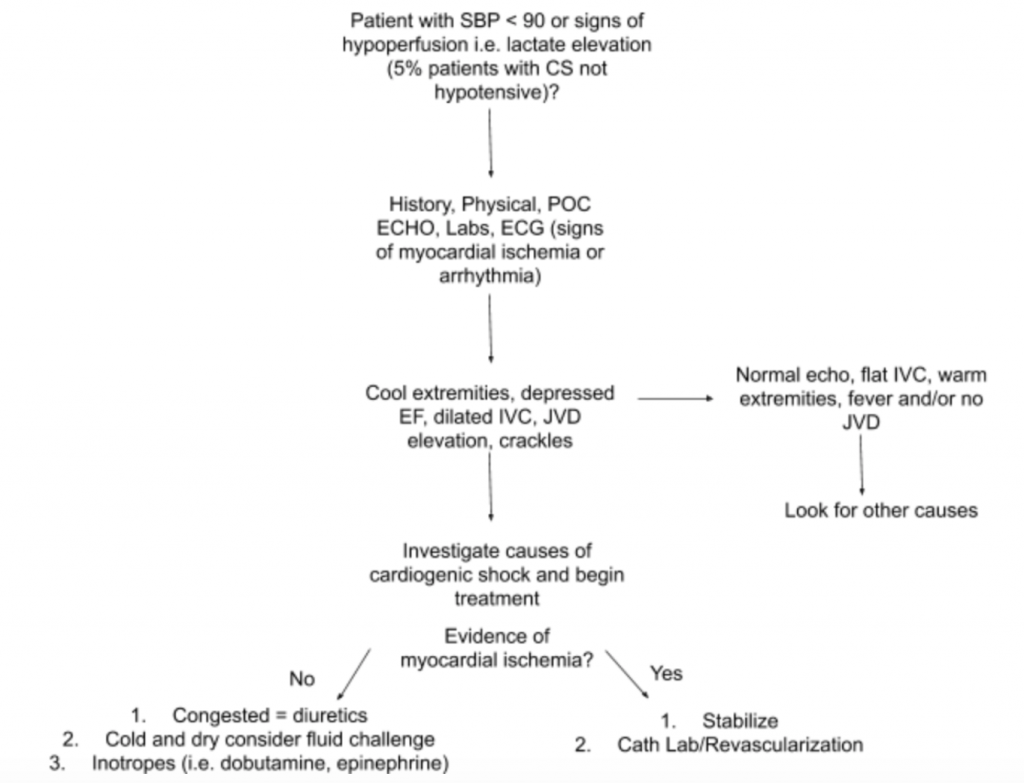
Anbefalet evalueringsvej
Som beskrevet ovenfor er der ikke en eneste undersøgelsesfinding eller laboratorietest, der kan diagnosticere CS, derfor, når der er en høj mistanke om CS i forbindelse med hypotension eller tegn på hypoperfusion, foreslår vi at bruge historie, en detaljeret fysisk undersøgelse, sengepladser i USA, laboratorier (specifikt kreatinin, lactat, troponin, BNP og andre markører for hypoperfusion / organskade) og EKG (som akut MI er den primære årsag til CS og tegn på iskæmi og kan kræve fremvækst revaskularisering) for at hjælpe med diagnosen (se figur 5). Overvej en arteriel kateterovervågning til BP og vejled behandlingen. Ud over en fokuseret hjerte- og lungeundersøgelse bør fysisk undersøgelse fokusere på JVD og ekstremitetsperfusion. RUSH-eksamen og beregning af EF / CO / CI gennem LVOT VTI-målinger beskrevet ovenfor er værdifulde supplementer til evalueringen. Brug af en omfattende tilgang til evaluering for CS vil skabe en bedre forståelse af denne heterogene sygdom og hjælpe med at styre styringen.
Sagens konklusion : Ved yderligere evaluering hæves patientens jugulære venetryk til 10 cmH20, og hans fødder er kølige med forsinket kapillærpåfyldning. RUSH-undersøgelse ved sengen viser bilateralt diffust lungeødem og en estimeret lav EF.LVOT VTI måles kun til 10 cm. EKG viser ST-forhøjelser i de prækordiale ledninger. Laktat og troponin er let forhøjede. Patienten stabiliseres med et kort forsøg med dobutamin, IV-furosemid og CPAP med moderat forbedring af vitalitet og respirationsstatus og sendes derefter til kat-laboratoriet for fremvoksende PCI.
Tag point med hjem:
- CS er primært forårsaget af en akut MI (~ 70%) og er fokus for de fleste undersøgelser, men andre årsager bør også overvejes (se fuld liste i figur 1).
- Dødelighed sekundær til CS er fortsat høj (~ 60%), selvom tidlig identifikation og intervention forbedrer overlevelsen.
- Udfør en omhyggelig fysisk undersøgelse på udkig efter hypoperfusion og overbelastning. JVP er en vigtig fysisk undersøgelseskomponent til diagnosen CS og er forbundet med øget dødelighed (RR = 1,52).
- RUSH-eksamen er både følsom og specifik (henholdsvis 0,89 og 0,97) i diagnosen CS. Ultralyd ved sengen skal gentages ofte, da de fleste patienter ikke oprindeligt er til stede i CS.
- Brug af LVOT VTI er en enkel og ikke-invasiv metode til evaluering af CO med lave målinger forbundet med ugunstige resultater.
- En foreslået tilgang til evaluering af patienter med mistanke om CS med fokus på dens heterogene patologi og præsentation er opsummeret i figur 5.
FOAMed Resources:
- EM i 5 : Shock
- emDocs: Cardiogenic Shock
- emDocs: ED Management of Heart Failure- Pearls and Fallfalls
- emDocs: RUSH (“Rapid Ultralyd for Shock”) Protokol
- emDocs: Den hypotensive ED-patient: En sekventiel systematisk tilgang
- Første 10 EM: Udifferentieret hypotension
