Caz: Un bărbat în vârstă de 73 de ani, cu antecedente de hipertensiune arterială, boală coronariană și miocard anterior infarctul (MI) prezintă la secția de urgență (DE) oboseală, dificultăți de respirație, scăderea cantității de urină și umflarea gleznei. La sosire, semnele sale vitale includ BP 87/58 mm Hg, HR 102, RR 24, saturație T 86% pe aerul din cameră și temperatura 98,2 F și are crăpături la auscultare. Cum ați gestiona acest pacient?
Ce este șocul cardiogen?
Deși definițiile variază, șocul cardiogen (CS) este un diagnostic clinic definit în general ca o stare de debit cardiac scăzut cu asociat perfuzie inadecvată a organului final sau hipoperfuzie tisulară secundară afectării cardiace. 1 Criteriile utilizate în mod obișnuit derivate din studiul SHOCK constau în hipotensiune arterială (SBP < 90mmHg sau > 90mmHg cu îngrijire de susținere), dovezi ale hipoperfuzie de organe și indicele cardiac (CI) < 2,2 L / min / m2 sau presiune de pană capilară pulmonară ≥ 15 mmHg 2,3 Deși această definiție este utilă pentru standardizarea criteriilor de incluziune pentru studiile clinice , este mai puțin valoros pentru diagnosticarea CS în departamentul de urgență (DE). La schimbarea într-un ED ocupat, CS poate fi dificil de diagnosticat din cauza diverselor prezentări, suprapunere cu alte stări de șoc (de exemplu sepsis), fiziopatologie slab înțeleasă, cauze complexe și multifactoriale și parametri hemodinamici variați.4 În absența debitului cardiac invaziv. (CO) și valorile PCWP, CS poate fi dedus folosind dovezi ale presiunilor de umplere crescute (adică congestie pulmonară sau JVP crescut), semne clinice de hipoperfuzie și un istoric și ecou sugestiv pentru insuficiență cardiacă. Mortalitatea secundară CS este ridicată (~ 25-70%), dar recunoașterea și intervenția timpurie îmbunătățesc supraviețuirea.4,5 Medicii de urgență au posibilitatea de a diagnostica CS la internare și trebuie să mențină o suspiciune clinică ridicată atunci când se întâlnesc cu orice pacient bolnav critic. Această revizuire se va concentra pe recunoaștere și sfaturi despre cum să nu ratați diagnosticul CS prin examen fizic, laboratoare, ecografie la noptieră și imagistică.
Care sunt cauzele șocului cardiogen?
Majoritatea studiilor de CS se concentrează pe pacienții cu CS secundari infarctelor miocardice (IM) care implică ventriculul stâng. Deși IM sunt principala cauză a CS (~ 70%), trebuie luată în considerare orice cauză a disfuncției ventriculare și a CO redus sau a indicelui cardiac (CO / suprafața corpului) ca cauză potențială.6 Aceasta include, dar nu se limitează la, cauze neischemice de insuficiență cardiacă dreaptă, miocardită, cardiomiopatie takotsubo, cardiomiopatie hipertrofică sau boală cardiacă valvulară (Tabelul 1). Pentru a face lucrurile mai provocatoare, CS este mai degrabă un continuum decât o stare statică, variind de la agravarea insuficienței cardiace la șocul refractar cu leziuni ireversibile ale organelor finale (Figura 1). CS devine și mai variabil odată cu apariția insultelor secundare, cum ar fi aritmii sau ischemie progresivă și acidoză. Trebuie remarcat faptul că, în 2/3 din cazuri, CS nu este prezent la internare, dar ulterior se dezvoltă în decurs de 48 de ore de la spitalizare ca pacient progresează pe continuumul șocului.7 Este important să reevaluăm frecvent semnele vitale ale pacienților, simptomele, examenul fizic și ecoul la pat.

Tabelul 1: Cauzele CS, adaptat de la Parrillo & Dellinger (2013) .8 70% din cazurile de CS sunt cauzate de IM acute. procente preluate din rezultatele registrului de încercare SHOCK.9.10
Figura 1: Continuum al CS, adaptat de la Bellumkonda și colab. . (2018) .3 Acest spectru se poate abate cu insulte secundare (ex. Noi aritmii).
Mortalitatea în șoc cardiogen
Deși mortalitatea secundară la CS rămâne ridicată4, recunoașterea și intervenția timpurie îmbunătățește supraviețuirea.5 Folosind datele care includeau registrul studiului SHOCK, mortalitatea în spital la 30 de zile a 1.217 pacienți cărora li s-a diagnosticat insuficiența CS secundară ventriculului stâng (VS) sau a ventriculului drept (RV) din cauza unui IM acut a fost de 57% . Dacă luați în considerare mai mulți factori de risc, în special șocul la internare, vârsta, grefa anterioară de bypass arterial coronarian (CABG), MI non-inferior, creatinină > 1,9 mg / dL, scăderea SBP, anoxic leziuni ale creierului și dovezi clinice ale hipoperfuziei organului final, pacienții ar putea fi împărțiți cu mortalitate cuprinsă între 12% și 88% .11 În studiul GRACE, CS a scăzut slab, dar semnificativ între 1999 și 2006, probabil datorită utilizării crescute a percutanatelor. intervenția coronariană (PCI), o formă importantă de intervenție timpurie pentru pacienții cu IM complicată de CS.12 Chiar și atunci când stratificați pacienții pe baza factorilor de risc, PCI și CABG au beneficiat atât pacienții cu risc scăzut, cât și cu cei cu risc ridicat.11 Rămâne diagnosticul precoce și tratamentul adecvat, în special în cazul ischemiei miocardice, un important factor modificabil al rezultatelor la pacienții cu CS.
În plus, cu cât CS progresează mai mult, cu atât este mai probabil să existe o boală inflamatorie inadaptativă. răspuns secundar unei creșteri a citokinelor precum TNF-alfa și IL-6, care inhibă activitatea cardiacă. 4,13 Există, de asemenea, o creștere a vasopresinei și a angiotensinei II, care crește sarcina, agravează CO și crește retenția de apă și sare, provocând astfel edem pulmonar. Oxidul nitric (NO) este, de asemenea, crescut prin activarea NO sintazei, ducând la vasodilatație și depresie miocardică. Toate aceste răspunsuri dezadaptative la CO scăzută și ischemie miocardică duc la deteriorarea țesutului cardiac, CO deprimat și șoc distributiv. Trebuie remarcat faptul că unele cazuri de CS sunt iatrogene, atunci când pacienții aflați în pragul insuficienței cardiace sunt tratați cu diuretice agresive, nitrați, beta-blocante, ACEI și morfină. 14 Prin urmare, ca prim medic care a evaluat pacienții, medicii de urgență trebuie să identifice și să trateze CS într-un mod sensibil la timp și clinic adecvat.
Evaluare clinică
Clasic, pacienții cu CS prezintă plângeri de dispnee, dureri toracice, oboseală și / sau umflături ale gleznei.15 Examenul fizic poate dezvălui semne de congestie, inclusiv edem periferic, distensie venoasă jugulară (JVD), crăpături / rale la auscultare și semne de hipoperfuzie, cum ar fi răceala, extremități slab perfuzate (Tabelul 2). Într-o mică revizuire retrospectivă a 30 de pacienți aflați în șoc nediferențiat, cei cu CS au avut mai multe șanse de a avea JVD (80% față de 0% și 20%), pielea rece (57,1% față de 14,3% și. 28,5%) și pulmonară rale (75% vs 16,7% și 8,3%) comparativ cu pacienții cu șoc distributiv și respectiv hipovolemic.16 Într-un alt studiu prospectiv cu 68 de pacienți, rezidenții au folosit rezultatele examenului clinic specific pentru a diferenția categoriile de șoc. CS a fost clasificat prin SBP mai puțin de 90, semne de ieșire redusă (mâini reci, reumplere capilară slabă și puls slab), presiune venoasă jugulară ridicată (JVP) > 7 cmH2O, galop S3 și trosnește la 1/3 din plămâni. Din 68 de pacienți, 11 au îndeplinit criteriile pentru CS. La pacienții cu dovezi ecocardiografice ale debitului cardiac scăzut, JVP crescut a prezis CS cu o precizie de 80%, care a fost neschimbată atunci când s-a adăugat prezența crăpăturilor.17
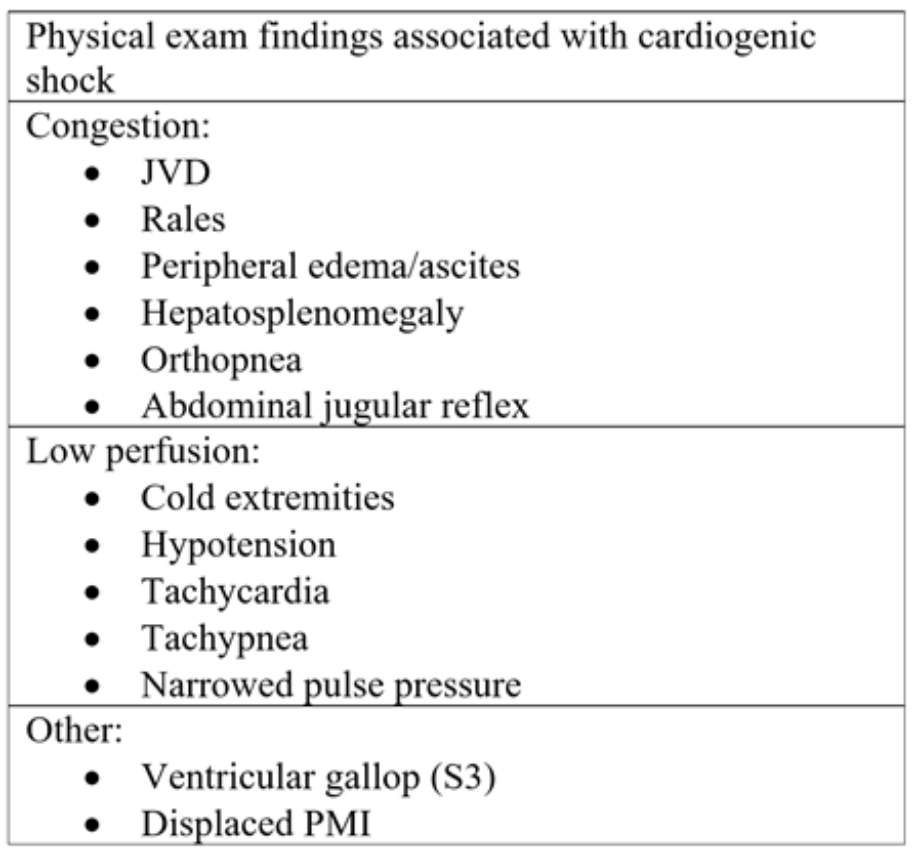
Tabelul 2: Componentele examenului fizic observate în insuficiența cardiacă acută și în șocul cardiogen ulterior.18
Deși JVP este un proxy util pentru presiunile crescute de pană 19, poate fi dificil de evaluat datorită habitusului corporal și poziționării pacientului (capul patului ar trebui să fie ridicat la 45 de grade, ceea ce poate fi dificil la pacienții cu ortopnee severă) .20 JVP se măsoară calculând cel mai înalt punct de pulsație în cm deasupra unghiului sternal și apoi se adaugă 5 (deoarece atriul drept este la 5 cm sub unghiul sternal), ceea ce se corelează cu distensia în cmH20 (Figura 2). Valorile crescute sunt adesea considerate mai mari de 6-8 cmH20,18 De remarcat, creșterea JVP este asociată cu un risc crescut de mortalitate, cu un risc relativ (RR) de 1,52,18
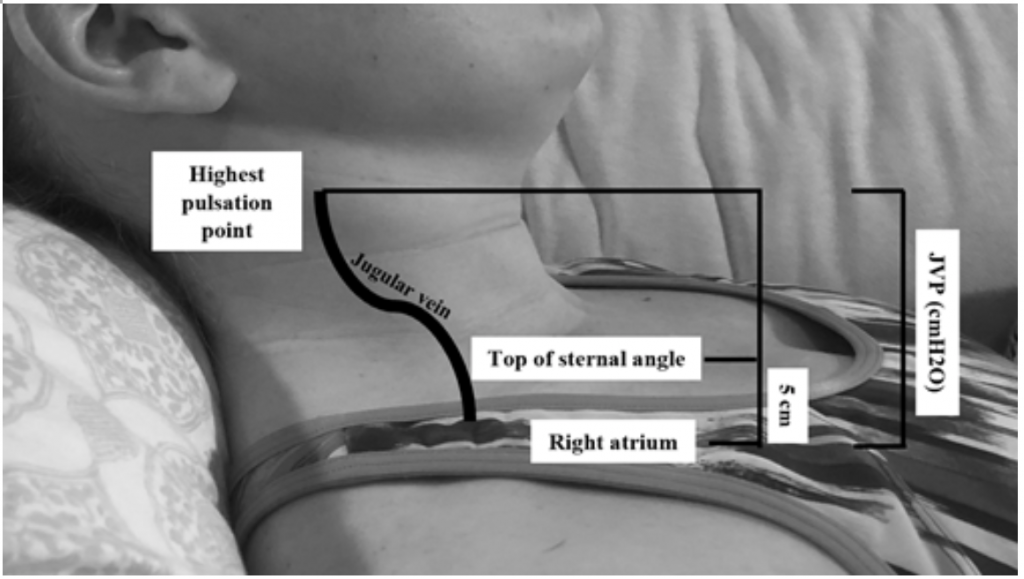
Figura 2: Măsurarea JVP, adaptat din Shah & Cowger (2014) .18
Laboratoarele pot afișa o acidoză metabolică (pe măsură ce lactatul crește din cauza ischemiei periferice), hipoperfuziei renale cu leziuni acute renale rezultate și posibile dovezi ale ischemiei cardiace cu modificări crescute ale troponinei și ale EKG.15 În studiul CardShock, un studiu observator multicentric, prospectiv, 219 CS la pacienți, nivelurile de lactat au fost semnificativ asociate cu creșterea mortalității (raportul de cote ajustat de 1,4) .6 Este important de menționat că creșterea lactatului nu este specifică sepsisului și poate fi observată în orice stare hipoperfuzată, cum ar fi CS.
Pe de altă parte, aceste constatări ale examenului fizic și parametrii hemodinamici nu sunt valabili întotdeauna. Într-un studiu care utilizează registrul SHOCK Trial, 5,2% dintre pacienții cu CS nu prezentau hipotensiune arterială evidentă, deși aveau semne de hipoperfuzie periferică și CI scăzută.21 Acest lucru se datorează probabil unei eliberări adaptive de catecolamină în CS precoce, care crește rezistența vasculară sistemică ( SVR) și menține temporar tensiunea arterială, deși, în general, cu o presiune a pulsului îngustă.22 Chiar și pacienții cu edem pulmonar semnificativ clinic la imagistică pot prezenta șuierătoare sau chiar sunete pulmonare clare, mai degrabă decât rale.23 Într-un studiu, congestia pulmonară a fost observată doar în aproximativ 2/3 cazuri de CS secundar MI.21 În plus, chiar și cu contractilitatea scăzută a VS, pacienții cu CS nu pot avea o reducere severă a FEVS. 14,24 De fapt, EF medie într-o cohortă de pacienți cu CS este de aproximativ 30%, ceea ce este redus, dar mai mare decât se aștepta.2
Deși examenul nu este perfect, un examen fizic detaliat care caută semne de congestie și hipoperfuzie periferică, împreună cu o analiză atentă a semnelor vitale și a laboratoarelor, poate fi primul indiciu al pacientului dumneavoastră care are șoc cardiogen.
ECHO la punctul de îngrijire pentru evaluarea șocului cardiogen
Atunci când pacienții prezintă ED hipotensiv sau hipoperfuzat, examenul RUSH este o modalitate rapidă de a diferenția șocul privind „pompa, rezervorul și conductele. ”25,26 Pentru CS, ecocardiograma transtoracică demonstrează în mod clasic un VS hipodinamic, dilatat, cu o presiune slabă a VS și o mișcare inadecvată asociată a pliantului anterior al valvei mitrale în timpul sistolei și diastolei (adică contractilitate slabă). Estimarea fracțiunii de ejecție (EF) și a CO (ca CO = volumul accident vascular cerebral (SV) x ritmul cardiac (HR)) prin simpla presare LV „globular” este o evaluare adecvată de către medici în contextul acut.27 În CS, vena inferioară cava (IVC), care este o măsurare indirectă a efectului intra volumul vascular, ar trebui să aibă un diametru de > 2 cm diametru și se prăbușește mai puțin de 50% odată cu inspirația. Aceste constatări se corelează cu o presiune venoasă centrală crescută.28 Cu toate acestea, evaluarea IVC poate fi inexactă dacă pacientul a primit deja vasodilatatoare, diuretice și / sau este ventilat.29 Ferestrele toracice pot prezenta edem pulmonar sub formă de B excesivă liniile („rachete pulmonare”) care sunt rezultatul îngroșării septului din acumularea de apă în interstitiu.30 Împreună cu congestia pulmonară, la examenul RUSH poate exista lichid pleural și peritoneal.25 Într-o meta-analiză care a folosit date din lucrări și două rapoarte de caz, protocolul RUSH s-a dovedit a fi atât sensibil cât și specific (0,89 și respectiv 0,97) în diagnosticul CS.31 În ciuda unui raport de probabilitate pozitiv (LR) ridicat de 22,29, a existat doar un nivel negativ moderat LR de 0,17, sugerând că examenul RUSH nu este testul perfect pentru a exclude CS. Prin urmare, examenul RUSH ar trebui utilizat în contextul unui istoric atent și a unui examen fizic, mai degrabă decât utilizat singur pentru a diagnostica cardiogeni. șoc c.
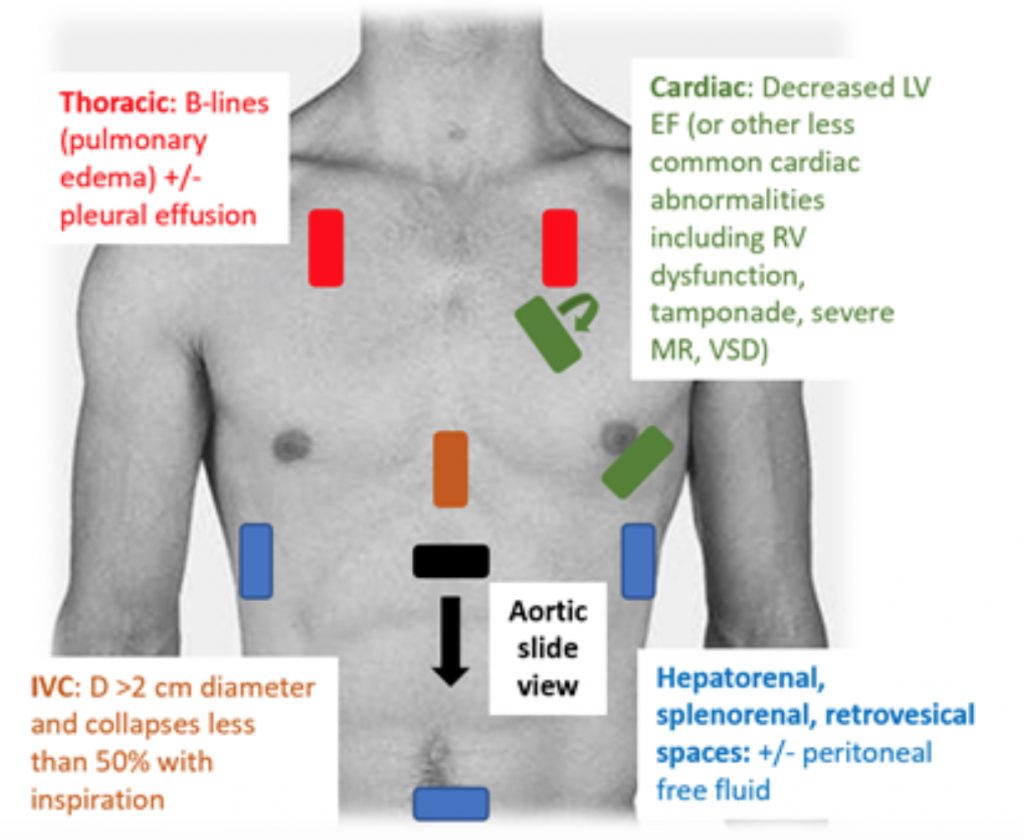
Figura 3: examen RUSH la pat la SUA pentru evaluarea hipotensiunii nediferențiate cu rezultatele asociate sugestive ale CS.25 , 26,29,30
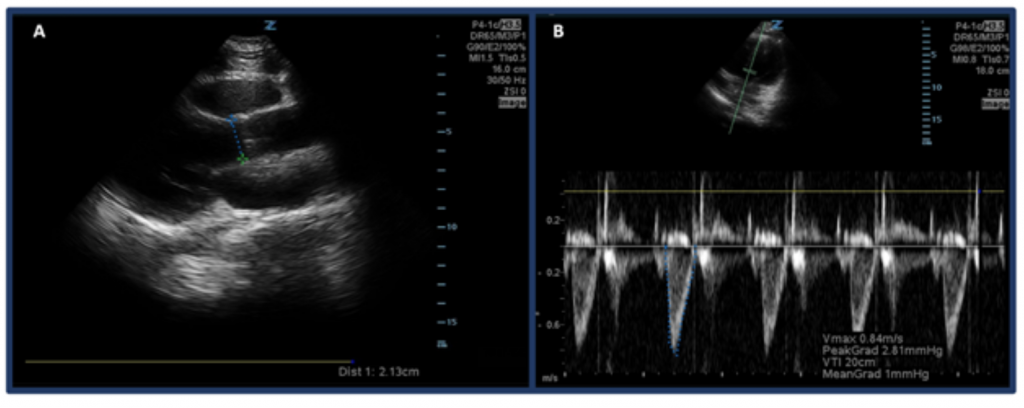
Mai degrabă decât estimarea CO prin „glob ocular”, o modalitate de a măsura CO cu ultrasunete este de a determina mai întâi SV folosind intervalul de timp al vitezei tractului de ieșire ventriculară stângă (LVOT VTI, sau de flux sanguin la nivelul tractului de ieșire aortică) și diametrul LVOT. În mod specific, SV, sau cantitatea de sânge expulzat prin ventriculul stâng la fiecare bătaie, este calculată de LVOT VTI × aria secțiunii transversale a LVOT .32 Pentru a măsura diametrul LVOT, așezați sonda matricială fazată în vizualizarea axei lungi parasternale și măsurați distanța LVOT chiar deasupra valvei aortice în timp ce se află în mijlocul sistolei. VTI se măsoară în imaginea apicală cu 5 camere. Folosind modul doppler cu unde pulsate, unda doppler este plasată chiar deasupra valvei aortice și se înregistrează formele de undă doppler. Asigurați-vă că aliniați axa cu tractul de evacuare cât mai bine posibil pentru a evita estimările excesive / subestimate. După selectarea instrumentului de măsurare „LVOT VTI”, măsurați forma de undă a unei perioade de ejecție.33,34 LVOT VTI normal variază între 18-22 cm, deși posibil mai scăzut cu HRs > 95 bpm. 35 La pacienții cu fibrilație atrială, măsurătorile VTI vor fi probabil o subestimare a valorii reale și, prin urmare, este sugerată o medie de 3-5 forme consecutive de undă. După cum ne-am aștepta, există o corelație între VTI LVOT scăzut și rezultatele adverse.32
Calea de evaluare recomandată
După cum sa discutat mai sus, nu există o singură constatare a examenului sau test de laborator care să poată diagnostica CS. Prin urmare, atunci când există o suspiciune ridicată de CS în situația de hipotensiune arterială sau semne de hipoperfuzie, vă sugerăm să folosiți istoricul, un examen fizic detaliat, patul SUA, laboratoare (în special creatinină, lactat, troponină, BNP și alți markeri de hipoperfuzie / leziuni ale organului final) și EKG (deoarece IM acut este principala cauză a CS și semne de ischemie și poate necesita apariție revascularizare) pentru a ajuta la diagnostic (vezi Figura 5). Luați în considerare un monitor al cateterului arterial până la TA și ghidați tratamentul. Dincolo de un examen cardiac și pulmonar focalizat, examenul fizic ar trebui să se concentreze pe JVD și pe perfuzia extremităților. Examenul RUSH și calculul EF / CO / CI prin măsurători LVOT VTI discutate mai sus sunt adjuvanți valoroși la evaluare. Utilizarea unei abordări cuprinzătoare pentru evaluarea CS va crea o mai bună înțelegere a acestei boli eterogene și va ajuta la ghidarea managementului.
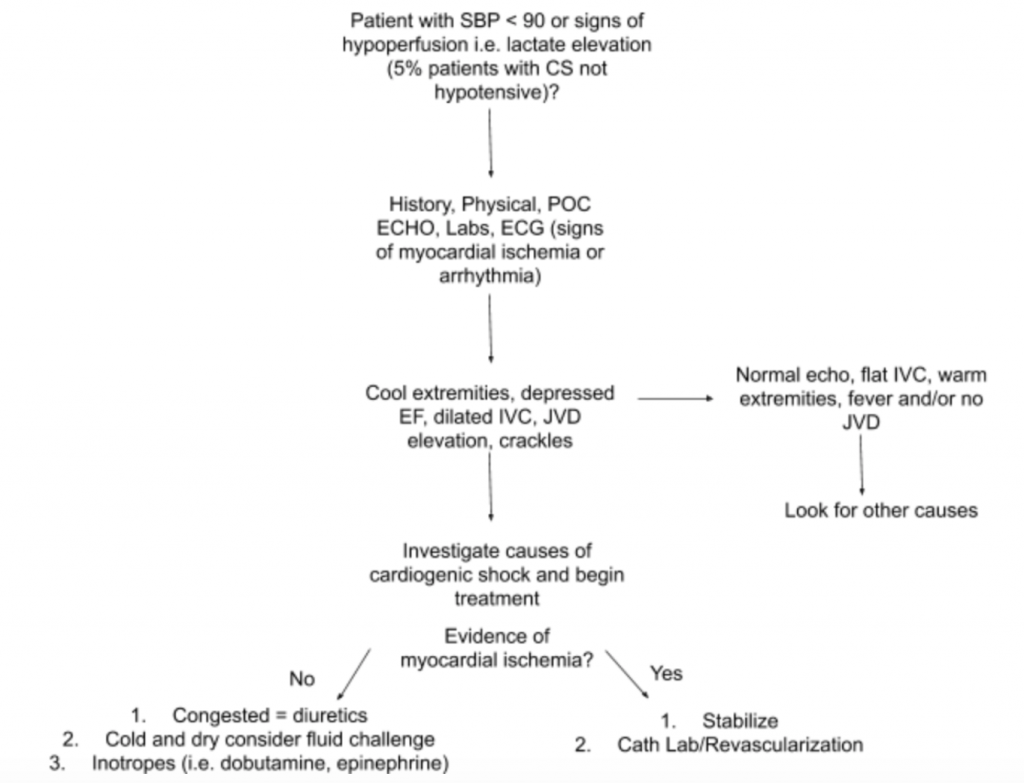
Concluzia cazului : La o evaluare ulterioară, presiunea venoasă jugulară a pacientului este crescută la 10 cmH20, iar picioarele lui sunt răcite cu reumplerea capilară întârziată. Examenul RUSH de la pat arată edem pulmonar difuz bilateral și un EF scăzut estimat.LVOT VTI se măsoară la numai 10 cm. EKG prezintă creșteri ST în conductele precordiale. Lactatul și troponina sunt ușor crescute. Pacientul este stabilizat cu un scurt studiu de dobutamină, furosemidă IV și CPAP cu îmbunătățire moderată a stării vitale și a stării respiratorii și ulterior trimis la laboratorul cat pentru PCI emergent.
Luați puncte acasă:
- CS este cauzată în primul rând de un IM acut (~ 70%) și se concentrează pe majoritatea studiilor, dar ar trebui luate în considerare și alte cauze (vezi lista completă din figura 1).
- Mortalitatea secundară CS rămâne ridicată (~ 60%), deși identificarea și intervenția timpurie îmbunătățesc supraviețuirea.
- Efectuați un examen fizic atent căutând hipoperfuzie și congestionare. JVP este o componentă importantă a examenului fizic pentru diagnosticul CS și este asociată cu creșterea mortalității (RR = 1,52).
- Examenul RUSH este atât sensibil cât și specific (0,89 și respectiv 0,97) în diagnosticul de CS. Ecografia la pat trebuie repetată frecvent, deoarece majoritatea pacienților nu sunt prezenți inițial în CS.
- Utilizarea LVOT VTI este o metodă simplă și neinvazivă pentru evaluarea CO cu măsurători reduse asociate cu rezultate adverse.
- O abordare sugerată pentru evaluarea pacienților cu suspiciune de CS, cu accent pe patologia și prezentarea sa eterogenă este rezumată în Figura 5.
FOAMed Resources:
- EM în 5 : Shock
- emDocs: Cardiogenic Shock
- emDocs: ED Managementul Insuficienței Cardiace- Perle și Capcane
- emDocs: Protocol RUSH („Rapid Ultrasound for Shock”)
- emDocs: Pacientul hipotensiv ED: o abordare sistematică secvențială
- Primii 10 EM: hipotensiune arterială nediferențiată
