Tanulási célok
- Írni a sav kémiai egyenlete savként és bázisként.
A víz (H2O) sok szempontból érdekes vegyület. Itt megvizsgáljuk, hogy képes-e savként vagy bázisként viselkedni.
Bizonyos körülmények között egy vízmolekula elfogadja a protont, és így Brønsted-Lowry bázisként működik. Láttunk egy példát a HCl H2O-ban való feloldására:
\
Más körülmények között egy vízmolekula protont adományozhat, és így Brønsted-Lowry savként viselkedhet. Például egy amidion jelenlétében (lásd a 4. példát a 10.2. Szakaszban) egy vízmolekula protont adományoz, aminek eredményeként ammóniát képez:
\
Ebben az esetben , Az NH2− egy Brønsted-Lowry bázis (a proton akceptor). A víz nem az egyetlen anyag, amely egyes esetekben savként, más esetekben bázisként reagálhat, de minden bizonnyal a leggyakoribb – és a legfontosabb – példa. Olyan anyagot, amely a körülményektől függően akár adományozhat, akár protont tud fogadni, amfiprotikus vegyületnek nevezzük. Minden 100 millió vízmolekulából körülbelül 6 (108-ból 6) megy át a következő reakcióban:
\
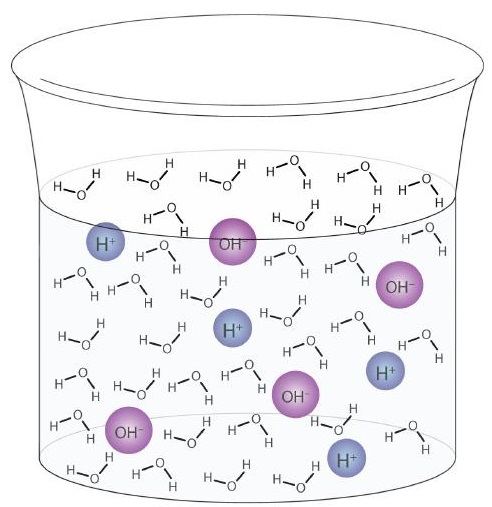
Ezt a folyamatot a víz autoionizációjának nevezzük (\ (\ PageIndex {1} ábra) \)) és minden vízmintában előfordul, akár tiszta, akár oldat része. Az autoionizáció bizonyos mértékig bármely amfiprotikus folyadékban bekövetkezik. (Összehasonlításképpen: a folyékony ammónia is autoionizálódik, de egymillió milliárdból csak körülbelül 1 molekula (1015-ből 1) reagál egy másik ammónia molekulával.)
Koncepció felülvizsgálati gyakorlatok
- Magyarázza el, hogy a víz hogyan viselkedhet savként.
- Magyarázza el, hogy a víz hogyan tud bázisként működni.
Válaszok
- Megfelelő körülmények között a H2O protont adományozhat, így Brønsted-Lowry savvá válik.
- Megfelelő körülmények között a H2O képes elfogadni egy protont, így Brønsted-Lowry lesz. bázis.
Kulcsfontosságú elvihető
- A vízmolekulák savként és bázisként is működhetnek, a a feltételek.
