Nociceptorer kan aktiveres af tre typer stimulus inden i målvævet – temperatur (termisk), mekanisk (fx stretch / stamme) og kemisk (f.eks. PH-ændring som et resultat af lokal inflammatorisk proces). Således kan en skadelig stimulus kategoriseres i en af disse tre grupper.
Udtrykkene nociception og smerte bør ikke bruges synonymt, fordi hver kan forekomme uden den anden. Smerter som følge af aktivering af nociceptorer kaldes nociceptive smerter. Nociceptiv smerte kan klassificeres efter det væv, hvori nociceptoraktivering forekom: overfladisk somatisk (f.eks. Hud), dyb somatisk (f.eks. Ledbånd / sener / knogler / muskler) eller visceral (indre organer).
Nociception-sti
Ikke alle nociceptorer reagerer på hver type af skadelige stimuli. Den tilsyneladende manglende reaktion på en skadelig stimulus kan skyldes forskellige receptorer placeret på endeterminalens membran (fri nerveende) eller stimulusintensiteten er utilstrækkelig. Normalt er stimuleringstærsklen for en nociceptor under vævsskadelig intensitet. Nociceptorer har heterogene egenskaber, der reagerer på multiple stimulusmodaliteter (polymodal). Imidlertid kan anvendelsen af skadelig stimulus af en modalitet ændre nociceptorens responsegenskaber til andre modaliteter. Anvendelsen af en bestemt stimulus i en given tidsperiode kan også inducere langsigtede ændringer i nociceptorens responsegenskaber. Skader og skader nedsætter tærsklen og øger responsens størrelse for en given stimulus, et fænomen kendt som perifer sensibilisering. Af særlig interesse er den varmefølsomme, men mekanisk ufølsomme ikke-myeliniserede afferenter, der kun udvikler mekanisk følsomhed i forbindelse med skade.
Nociceptorer har det morfologiske udseende af frie nerveender. Udtrykket “fri nerveende” indikerer, at der i lysmikroskopet ikke kan genkendes nogen (korpuskulær) modtagelig struktur. På nuværende tidspunkt er der ingen klare ultrastrukturelle forskelle mellem ikke-nociceptive frie nerveender (f.eks. Følsomme mekanoreceptorer og termoreceptorer) og nociceptive Funktionelt forskellige frie nerveender
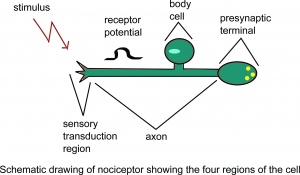
Skematisk tegning af nociceptor, der viser fire regioner i cellen.
antages at have forskellige sæt receptormolekyler i deres axonale membran. Receptormolekyler, der er særligt vigtige for funktionen af muskelnociceptorer, er syrefølende ionkanaler (ASIC), der åbner ved en lav vævs-pH, P2X3-receptorer, der aktiveres ved binding af adenosintriphosphat (ATP), og den forbigående receptorpotentiale-undertype 1 (TRPV1), der er følsom over for høje temperaturer, capsaicin-kemikalie og lav pH. neuropeptidsubstans P har er rapporteret at være overvejende til stede i nociceptive afferente fibre. Mens der er adskillige neurotransmittere i nervesystemet, er de tre mest almindelige, der deltager i nociceptiv transmission, peptider, puriner og excitatoriske aminosyrer (EAA). EAA, især glutamat, producerer det indledende excitatoriske respons på det postsynaptiske, andenordens neuron, efterfulgt af frigivelse af peptider, inklusive substans P, hvilket forårsager en mere langvarig depolarisering og vedvarende nociceptiv transmission
Nociceptorer er til stede i mange kropsvæv, men er ikke fundet i ledbrusk, visceral pleura, lungeparenkym, perikardium, hjerne og ledningsvæv.
Typer af nociceptorer
Flere klasser af nociceptorer er blevet beskrevet. Nogle nociceptorer reagerer på skadelig kulde, skadelig varme og mekaniske stimuli med høj tærskel såvel som en række kemiske mediatorer. Selvom polymodale kan nociceptorer opdeles yderligere i to hovedklasser på baggrund af respons på mekaniske stimuli, hvilket fører til en skelnen mellem mekanisk følsomme afferenter (MSA) og mekanisk ufølsomme afferenter (MIA) defineret som afferenter, der har meget høje mekaniske tærskler eller reagerer ikke på mekaniske stimuli.
Nociceptorer kan klassificeres efter ledningshastigheden af deres axoner eller fiberdiameter, dette er henholdsvis gruppe III og IV ord Aδ og C.
Type Aδ myelinerede afferenter med medium diameter, der medierer akut, godt lokaliseret, skarp stikkende type smerte, kendt som gruppe III afferent. Aδ afferente fibre har gennemsnitlig fiberdiameter 2-5 mm og ledende hastighed 5-30 m / s. Aδ-nociceptorer kan yderligere opdeles i to typer (det ser ud til at eksistere ca. 50% af hver type)
- Type I Aδ er mekanisk følsomme afferenter (MSA), der reagerer med en langsomt tilpasende udledning til stærk punktum pres.De reagerer også på varme og kemiske stimuli og har relativt høje varmetærskler (> 50C).
- Type II Aδ-nociceptorer har lavere varmetærskel end Type I-enheder, men har meget høje mekaniske tærskler (kaldet mekanisk ufølsomme afferenter – MIA’er). Aktiviteten af denne afferente formidler næsten helt sikkert det “første” akutte smertereaktion på skadelig varme. De er rapporteret i knæleddet, indvolde og hornhinde.
Type C umyeliniserede afferente fibre, der overfører dårligt lokaliseret kedelig, brændende, såkaldt “anden” eller langsom smerte er kendt som gruppe IV. Den gennemsnitlige fiberdiameter er under 2 mm og den ledende hastighed er 2 m / s eller mindre. De umyeliniserede C-fibre er også heterogene. C-fiber afferenter kan opdeles i to klasser baseret på deres respons på mekaniske stimuli. Ligesom de myeliniserede Aδ-afferente fibre er de fleste C-fibre polymodale, dvs. de inkluderer en population, der er både mekanisk og varmefølsom (CMH’er). Responsen fra CMH’er er også stærkt påvirket af stimulushistorikken. Både træthed og sensibilisering observeres. Et fald i reaktionen på varme observeres også efter mekaniske stimuli påført det receptive felt eller elektriske stimuli på nervestammen. Dette antyder, at træthed som reaktion på en given stimulusmodalitet kan induceres ved heterolog stimulering, det vil sige ved excitation med en stimulus af en anden modalitet. Disse er den overvejende type C-fiber-nociceptorer i pattedyrshud. Mekanisk ufølsomme C-fibre (C-MIA’er) reagerer enten ikke på mekaniske stimuli eller har en meget høj mekanisk tærskel. Disse afferenter reagerer på varme og forskellige skadelige kemiske stimuli (f.eks. Capsaicin, histamin) og betragtes ofte som kemoreceptorer.
Sammenfattende med ovenstående er øjeblikkelig, godt lokaliseret, nærig smertefølelse medieret af myelinerede nervefibre med lille diameter, type Aδ. C-fibre formidler dårligt lokaliseret anatomisk type smerte, den har en ondt og brændende karakter, kommer senere end den første første sensation, og det er svært at estimere dens styrke.
TRP-kanaler
Nociceptorer reagerer på et bestemt temperaturområde og mekanisk stimulus.
Den perifere ende af axonen indeholder indkapslede proteiner kaldet transduktionsproteiner (TRP), som kan aktiveres af en specifik stimulus. Den transiente receptorpotentiale (TRP) multigen superfamilie koder for integrerede membranproteiner, der fungerer som ionkanaler. TRP-kanalfamilien er af interesse, fordi flere medlemmer er blevet impliceret i nociceptorsignaltransduktion.
Skadelig kulde og skadelig varmestimuli påvises af Aδ- og C-fibernociceptorer. TRP-kanalfamilien tilvejebringer en gruppe molekyler udstyret til at detektere termiske ændringer. Hele temperaturområdet, fra skadelig kulde til skadelig varme, ser ud til at blive transduceret af aktiviteten i disse ionkanaler. TRPM8 og TRPV3 / 4 koder henholdsvis køligt og varmt, TRPA1 transducerer skadelig kulde og TRPV1 / 2 fornemmer skadelig varme. Nogle af de termosensitive TRP-kanaler reagerer også på kemiske og mekaniske stimuli.
For eksempel er TRPV1 afgørende for transduktion af nociceptivet ved inflammatoriske og hypotermiske virkninger af vanilloidforbindelser og bidrager til akut termisk nociception og termisk hyperalgesi efter vævsskade. TRPV1-strøm forstærkes af bradykinin og nervevækstfaktor via flere mulige mekanismer og aktiveres også af protoner og capsaicin, den ” varme ” forbindelse i chili-peber. I modsætning til hyperalgesi efter intense skadelige stimuli kan langvarig eksponering for capsaicin resultere i efterfølgende desensibilisering.
Mens opdagelsen af termosensitive TRP-kanaler i høj grad har forbedret vores forståelse af transduktionsmekanismer for termiske stimuli, er fund hos dyr med selektive gendeletioner klart indikerer, at flere og endnu ukendte transduktionsmekanismer er involveret af termiske stimuli.
Kemiske mediatorer
Skader resulterer i lokal frigivelse af adskillige kemikalier fra ikke-neuronale celler (fx fibroblaster, mastceller, neutrofiler, monocytter og blodplader) såvel som fra de sensoriske terminaler af primære afferente fibre der formidler eller letter den inflammatoriske proces. Inflammatoriske mediatorer inkluderer prostaglandiner, leukotriener, bradykinin, serotonin, histamin, SP, thromboxaner, blodpladeaktiverende faktor, puriner, såsom adenosin og ATP, protoner og frie radikaler. Cytokiner, såsom interleukiner og tumornekrosefaktor, og neurotrofiner, især NGF, genereres også under inflammation.Det er værd at bemærke, at de fleste af disse kemikalier (hovedsagelig stoffer såsom bradykinin og prostaglandin E2) generelt anses for ikke at aktivere nociceptorer direkte, men snarere øge følelsen af smerte som reaktion på naturlige stimuli og andre endogene kemikalier ved at øge handlingsfrekvensen potentiel affyring.
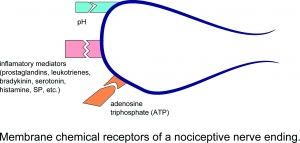
Membrankemiske receptorer for en nociceptiv nerveende.
Aktivering af nociceptorer transmitterer ikke kun afledte meddelelser til rygmarvets dorsale horn, men initierer også processen med neurogen inflammation. Neurogen betændelse forårsager frigivelse af neurotransmittere, især stof P og calcitonin-genrelateret peptid (CGRP), hvilket fører til svær vasodilatation såvel som plasmalækage af proteiner og væske fra post kapillære vener.
To kemikalier er af særlig interesse:
- Adenosintrifosfat (ATP)
ATP er det energibærende molekyle i alle kroppens celler. Det frigøres fra alle væv under traumer og andre patologiske ændringer, der er forbundet med celledød. Af denne grund er ATP blevet betragtet som et generelt signalstof for vævstraumer og smerter. I humane mikronurografiske studier aktiverede injektion af ATP 60% af mechano-responsive og mechano-ufølsomme C-nociceptive fibre uden at sensibilisere disse fibre for mekaniske eller varme stimuli. ATP aktiverer purinergiske P2X3-receptorer i nociceptorer, der forårsager afladning. ATP er især vigtigt for muskelsmerter, fordi det er til stede i muskelceller i høj koncentration.
- Protonerændring i vævs-pH
Syrefølende ionkanaler (ASIC’er) udgør en familie af receptormolekyler, der er følsomme over for et fald i pH og åbne ved forskellige pH-værdier. Kanalproteinerne reagerer allerede for små pH-ændringer. Denne receptorfamilie (for eksempel ASIC1 og ASIC3) er særlig vigtig for muskelsmerter, fordi næsten alle patologiske ændringer i muskler ledsages af et fald i vævets pH, fx udmattende træning, iskæmi og in-ammation.
Placering af nociceptorer
Nociceptors cellelegemer er placeret i dorsale rodganglier (DRG) for periferien og trigeminusganglierne for ansigtet. Deres axoner strækker sig ind i det perifere nervesystem og slutter i grene, der skaber modtagelige felter.
- Hud
Frie nerveender, der ender i huden, er maskineriet til signalering af lokale mekaniske, termiske og kemiske ændringer. Det store flertal af frie nerveender i huden kaldes polymodale nociceptorer, fordi de indeholder flere receptorer og således reagerer på forskellige kombinationer af ovennævnte stimulus. Type I Aδ-mekanismereceptorenheder med høj tærskel er tæt fordelt i behåret og glat hud.
- Muskler
Receptormolekyler, der er særligt vigtige for funktion af muskelnociceptorer er syrefølende ionkanaler (ASIC’er), der åbner ved et lavt vævs-pH, P2X3-receptorer, der aktiveres ved binding af adenosintrifosfat (ATP), og den forbigående receptorpotentialreceptorsubtype 1 (TRPV1), der er følsom over for høj temperaturer og lav pH.
I skeletmuskel ser de frie nerveender ud til at være fordelt ret jævnt. Der blev ikke fundet nogen forskel mellem de proximale og distale dele af rotte gastrocnemius – soleus muskel. I den samme undersøgelse viste det sig imidlertid, at nervefibertætheden i peritendineum af rotte-calcaneal-senen viste sig at være flere gange højere end i GS-musklen. I modsætning hertil var kollagenfiberknuderne i selve senevævet næsten fri for frie nerveender.
- Sener
Innervation af Achilles sener menneske leveres af nerver fra de omgivende muskler og af små fasciculi fra kutane nerver, men dette involverer al nerveslutning. Gratis nerveender er repræsenteret inde i senerne, men hovedsageligt i peritendinøst væv er smertereceptorer. Antallet og placeringen af alle nervefibre og nerveender varierer alt efter senens funktion og er mere repræsenteret i de mindre sener, der er involveret i fine bevægelser.
- Led
Nociceptorer i led er placeret i ledkapslen, ledbånd og proksimale sener, knogle, periosteum, ledfedtpude og omkring blodkar, men ikke i ledbrusk. Nociceptive afferenter med høj tærskel ophører primært i synovium og periosteum og reagerer normalt kun på bevægelsen af leddet ud over arbejdsgrænserne. Efter ledskader kombineres to faktorer for at ændre den mekaniske følsomhed af artikulære nociceptorer.For det første ændrer fysiske ændringer (leddudstrømning og vævsødem) de hvilende og bevægelsesinducerede kræfter, der udøves på leddvævene, og for det andet sensibiliserer in-ammatory mediatorer, der frigøres i det beskadigede væv, artikulære nociceptive afferenter ved at binde til receptorer på nerveender. Mange nociceptorer i leddet reagerer på uskadelige bevægelser, men aktiveres i stigende grad, når bevægelser overstiger det fysiologiske arbejdsområde, mens andre nociceptorer udelukkende er aktive under skadelige bevægelser. Den tredje gruppe af såkaldte tavse nociceptorer er normalt inaktive og reagerer kun under patologiske omstændigheder, som f.eks. Ved ammation.
Det er påvist, at lændehalsens facetledskapsel er rigtinerveret af nociceptorer og proprioceptive fibre. I normal tilstand har nociceptorer som dem, der ses i facetledskapslen, en høj tærskel og forventes ikke at udledes, medmindre belastningen er suprafysiologisk. Imidlertid kan synovitis kemiske mediatorer i nærværelse af patologisk ledbetændelse sensibilisere disse nociceptorer, og suprafysiologiske niveauer af stress er muligvis ikke længere nødvendige for at stimulere smerte. Sådanne inflammatoriske mediatorer (substans P, bradykinin, phospholipase A2) er blevet påvist i facetledskapslen.
Nociceptorer i intervertebrale skiver er normalt begrænset til den ydre tredjedel af ringen, kan være substratet for diskogen smerte, når de udvides over det større ringformede område og trænger længere ind i den degenererede skive langs vaskulaturen og fi surer. Disse C- og A δ-fibre er sandsynligvis ansvarlige for transmission af smertereaktioner. Det bageste langsgående ledbånd og de ydre ringformede fi brosuslag på intervertebral skive indeholder masser af nociceptive fibre. Nervefibre og nerveender forekommer også i den subchondrale knogle i de zygapofysiale led. De forekommer i erosionskanaler, der strækker sig fra den subchondrale knogle til ledbrusk.
En human undersøgelse fra (Kiter et al., 2010) viste både frie og indkapslede nerveender i det humane iliolumbar ligament. Studie af (Hirsch et al., 1963) foreslog tilstedeværelsen af fi ner nervefibre og komplekse uindkapslede ender i de supraspinøse og intraspinøse ledbånd.
- Viscera
Viscerale nociceptorer reagerer ikke på skære- eller brændeskader som deres kolleger i det perifere kutane væv. I stedet aktiveres de som reaktion på patologisk ændring. Smerteproducerende stimuli i indvoldene inklusive trækkraft på mesenteriet, betændelse, udspilning af hule muskelvæggede organer såsom gastrointestinale, urinveje, galdeblære og stærke sammentrækninger af muskellag, der omgiver sådanne hule organer, kemikalier irriterende eller iskæmi i organer såsom hjerte. Fordelingen af disse fibre varierer mellem organer. Højtærskelreceptorer udelukkende innerverede organer, hvorfra smerte er den eneste bevidste fornemmelse (dvs. urinleder, nyre, lunger, hjerte), men er relativt få i organer, der giver uskadelige og skadelige fornemmelser (fx tyktarm, mave og blære), innerveret for det meste af lavterskelreceptorer. Organer, såsom lever, lunger, nyrer og bugspytkirtlen, har få receptorer, men smerten fra disse organer kommer hovedsageligt fra aktivering af receptorer i kapslerne i disse organer. Nociceptiv stimulering af indvolde fører til diffus smerte, som er vanskelig at lokalisere. Afferente nociceptive fibre i indvolde findes i forbindelse med sympatiske og parasympatiske nerver. Størstedelen af viscerale organer er innerveret af vagal nerve, men undersøgelser viser ikke klart, om denne nerve er i stand til at bære nociceptiv afferent input. Imidlertid viser nogle undersøgelser tydeligt, at vagale afferenter overfører information om mekaniske stimuli med høj intensitet til centralnervesystemet. En række undersøgelser, der involverer mennesker eller dyr, har vist, at forsøgspersoner med spinal cor læsion er i stand til at rapportere smerter, der sandsynligvis stammer fra området med viscerale organer.
- 1.0 1.1 Loeser JD, Treede RD. Kyoto-protokollen fra IASP Basic Pain Terminology. Smerte. 2008; 137 (3): 473–7. doi: 10.1016 / j.pain.2008.04.025. PMID 18583048
- Basbaum AI, Jessell T. Perception of Pain. I: Kandel ER, Schwartz J, Jessell T. redaktører. Principper for neurovidenskab. New York: Appleton og Lange; 2000. s472-491
- 3.0 3.1 3.2 3.3 3.4 3.5 Meyer RA, Ringkamp M, Campbell JN, Raja SN. Perifere mekanismer for kutan nociception. I: McMahon SB, Koltzenburg M, redaktører. Wall and Melzacks Textbook of Pain. London: Elsevier; 2006. s3-34.
- Lloyd DPC. Neuronmønstre, der styrer transmission af ipsilaterale bagbenreflekser hos kat. J Neurophysiol. 1943; 6: 293–315
- 5,0 5,1 5,2 Schaible HG, Schmidt RF. Virkninger af en eksperimentel arthritis på de sensoriske egenskaber ved fine artikulære afferente enheder. Journal of Neurophysiology. 1985; 54: 1109-1122
- Häbler HJ, Jänig W, Koltzenburg M.En ny type umyeliniseret kemosensitiv nociceptor i den akut betændte urinblære. Agenter og handlinger. 1988; 25: 219-221
- Tanelian DL. Kolinererg aktivering af en population af hornhindens afferente nerver. Eksperimentel hjerneforskning. 1991; 86: 414-420
- LaMotte RH, Campbell JN. Sammenligning af reaktioner af varme og nociceptive afferenter af C-fiber i abe med menneskelige vurderinger af termisk smerte. Journal of Neurophysiology. 1978; 41: 509-528
- Treede RD, Meyer RA, Raja SN, Campbell JN. Bevis for to forskellige varmetransduktionsmekanismer i nociceptive primære afferenter, der innerverer abeskind. Tidsskrift for fysiologi. 1995; 483: 747-758
- Schepers RJ, Ringkamp M. Termoreceptorer og varmefølsomme afferenter. Neurovidenskab & Bioadfærdsmæssige anmeldelser. 2010; 34 (2): 177-184
- Caterina MJ, Schumacher MA, Tominaga M, Rosen TA, Levine JD, Julius D. Capsaicinreceptoren: en varmeaktiveret ionkanal i smertevejen. Natur 1997; 389: 816–824
- Bjur D, Alfredson H, Forsgren S. Den innerveringsmønster af den menneskelige akillessene: undersøgelser af den normale og tendinose senen med markører til generel og sensorisk innervation. Cell Tissue Res. 2005; 320: 201-206
- 13.0 13.1 Ashton IK, Ashton BA, Gibson SJ, Polak JM, Jaffray DC, Eisenstein SM. Morfologisk basis for rygsmerter: demonstration af nervefibre og neuropeptider i lænde-facets ledkapsel, men ikke i ligamentum fl avum. J Orthop Res. 1992; 10 (1): 72-78
- Kiter E, Karaboyun T, Tufan AC, Acar K. ImmunohistochemicalfckLRdemonstration af frie nerveender i iliolumbar ligament. Rygrad. 2010; 35 (4): E101-4. doi: 10.1097 / BRS.0b013e3181ae561d.
- Hirsch C, Ingelmark BE, Miller M. Det anatomiske grundlag for lowfckLRback smerter. Undersøgelser af tilstedeværelsen af sensoriske nerveender infckLRligamentøse, kapsulære og intervertebrale diskstrukturer i fckLRhumane lændehvirvelsøjlen. Acta Orthop Scand. 1963; 33: 1–17.
- Moller, Aage (2014-04-22). Smerter, dets anatomi, fysiologi og behandling. Kindle-udgave.
