Proč lidé říkají, že voda je nezbytná pro život? Proč jsme nikdy nenašli žádný živý organismus, který by mohl vzkvétat ve zcela suchém prostředí? Jak to, že něco bez zápachu, barvy, chuti a relativně nereaktivní tvoří 60% naší tělesné hmotnosti? Proč nelze použít jinou kapalinu? Proč voda?
Voda má několik vlastností, díky nimž je jedinečná mezi sloučeninami a umožňuje fungování všech forem známého života.
Je to jediná přírodní látka ve všech třech fyzikálních stavech při teplotách, které se přirozeně vyskytují na Zemi.
To znamená, že vidíme vodu jako kapalinu, v řekách a mořích, pevnou látku, jako sníh a led a jako plyn, jako mraky nebo páru. Pokud by tomu tak nebylo, koloběh vody by byl úplně jiný (co kdyby se voda na slunci nevypařila?); Sníh a led by nemuseli existovat (a tisíce druhů by nyní byly bez domova) a počasí by bylo velmi odlišné ( stále by pršelo?). Napadá vás ještě něco jiného, co by bylo jiné? Myslíte si, že bychom mohli stále žít, kdyby voda byla pouze kapalinou při teplotách, které se na Zemi vyskytují přirozeně? A co jen plyn / pevná látka?
Led je méně hustý než voda
To jen znamená, že led plave na vodě a že jezera zamrzají shora dolů. To je zjevně důležité pro zvířata žijící na ledu, protože jejich stanoviště by byla značně omezená nebo neexistující pokud by se led potopil. Podobně by to ovlivnilo život ryb a jiných rybníků, kdyby jezera a rybníky zmrzly zdola nahoru – vrstva zmrzlé vody v horní části rybníka poskytuje určitou izolaci a brání tomu, aby zbytek vody zchladl, protože rychle. Dělá to tak, že vytvoří bariéru mezi zimou vzduch a voda dole. To znamená, že velké vodní útvary nezchladnou hlouběji dolů tak rychle, jak by mohly, kdyby se led potopil a pomohl divokým zvířatům přežít v rybnících přes zimu. Voda ve skutečnosti hustne, je ochlazována, dokud nedosáhne 4 $ C (který můžete vidět na grafu), poté opět zesílí. Většina látek postupně ochlazuje, postupně zhustne. Níže uvedený graf ukazuje, jak se hustota vody mění s teplotou.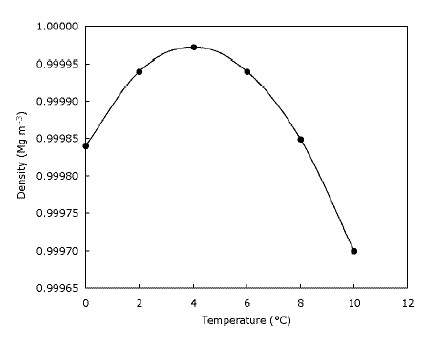
Voda má ve srovnání s jinými podobnými molekulami velmi vysokou teplotu tání a bod varu
To znamená, že se na Zemi pohlíží jako na tuhou látku, kapalinu a plyn. Pokud voda nebyla kapalina při většině teplot, které na Zemi vidíme, všechna moře by byla ledová, nepršelo by, nic, co by rostliny shromažďovaly a zvířata pila. I naše buňky jsou naplněny tekutou vodou, což by také nebylo možné.
Nazývá se „univerzální rozpouštědlo“, protože je schopné rozpouštět tolik látek.
Voda v našich tělech i Většinou jsou obsaženy v našich buňkách, kde jim dává jasný tvar a v nich jsou rozpuštěny miliardy užitečných molekul. Naše buňky musí být naplněny vodou, aby fungovaly správně, protože enzymy v nich fungují pouze v roztoku. Voda je také prostředek, kterým dochází k transportu v našem těle. „Krev je většinou voda a obsahuje rozpuštěné hormony a plyny, jakož i toxiny, jako je močovina, které jsou z těla odstraňovány ještě větším množstvím vody. K transportu ve vodě dochází také na mnohem menší měřítko: když je něco rozpuštěno, může se pohybovat v rozpouštědle. Například pokud enzym potřebuje aktivovat ionty vápníku a začít pracovat, setká se s nimi, když se pohybují v roztoku uvnitř buňky. Čím vyšší je koncentrace vápníku v buňce, tím pravděpodobněji se enzym dříve setká s iontem. Možná jste se také dozvěděli o difúzi a osmóze, což jsou klíčové pojmy pro pochopení toho, jak buňky fungují a spoléhají na přítomnost vody
Voda má vysokou specifickou hodnotu tepelná kapacita.
I když tento nápad zní trochu zastrašujícím dojmem, je ve skutečnosti velmi jednoduchý – znamená to jen to, že k tomu, aby voda byla o něco teplejší, je zapotřebí hodně energie. Proto v horkém dni písek na pláži může být příliš horko na chůzi dál, ale moře se stále cítí chladné; energie ze slunce je dost na to, aby písek hodně zahřál, ale voda jen málo. To má některé velmi důležité důsledky, zejména pro organismy, které žijí ve vodě. Moře, jezera a řeky udržují mnohem konstantní teplotu než vzduch, což znamená, že zvířata mohou žít ve vodě po celý rok, aniž by se musela přizpůsobovat velkým teplotním změnám (Co si myslíte, že by se stalo, kdyby se voda ochlazovala snadněji? představují pro organismy žijící v malém rybníku?). To také znamená, že je velmi těžké rychle změnit naši tělesnou teplotu, a proto náš mozek mnohem snáze udržuje konstantní tělesnou teplotu (Co by se mohlo stát, kdyby se naše tělesná teplota změnila rychle a snadno?). Povrchové napětí
Možná jste si všimli, že když napíchnete jehlu na povrch misky s vodou, plave, ale pokud ji do ní hodíte, potápí se.Je to proto, že jehla je hustší než voda, takže se chce potápět, ale drží ji povrchové napětí vody. Povrchové napětí je vlastnost, která znamená, že povrch vody se nechce lámat – je „lepkavý“. Můžete to také vidět, když naplníte šálek až po okraj, protože povrch vody bude držet pohromadě a odolá rozlití. Vysoké povrchové napětí vody je důvodem, že některé mušky mohou přistát na jejím povrchu bez potopení. Tento koncept také velmi úzce souvisí s jiným, myšlenkou kapilárního působení.
Kapilárního působení
Podobně jako u povrchového napětí se to točí kolem myšlenky, že molekuly vody se „slepí“. Pokud dáte velmi jemnou trubičku do kádinky s vodou, uvidíte, že část vody cestuje krátkou cestou nahoru trubicí; toto se nazývá kapilární působení a je způsobeno tím, že voda ulpívá na stranách trubice a na jiných molekulách vody a tahá je s ní nahoru trubicí. Hmotnost tažené vody je nakonec příliš velká na to, aby ji bylo možné unést, a voda se po dosažení rovnováhy zastaví. Stejný princip umožňuje rostlinám čerpat vodu ze země; jak molekuly vody cestují po stonku, více molekul vody se k nim přichytává a více se drží těch, a tak dále, dokud není v xylému transportován sloupec vody (více informací naleznete v části „transpirace“).
Ale proč?
Všechny tyto vlastnosti vody jsou zásadní pro život, jak ho známe, ale proč je voda má? Nedělá tyto věci také žádná jiná látka? V čem je voda odlišná? Abyste pochopili odpovědi na tyto otázky, musíte studovat molekulární strukturu vody. Chemický vzorec pro vodu je H2O, což znamená, že obsahuje dva atomy vodíku kovalentně navázané na atom kyslíku, například takto: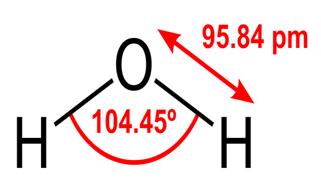
Délka 95,84 minut ukazuje délku vazba mezi kyslíkem a vodíkem; jedna hodina je zkratka pro pikometr, což je jedna biliontina metru. Zobrazený úhel je ostrý úhel mezi dvěma vodíkovými jádry (máte nějaké představy o tom, proč to není $ 180 ^ \ Circ $? Proč by to mělo být $ 180 ^ \ Circ $?) Tento diagram představuje vazby jako čáry, které vypadá to, že jsou v každém bodě stejné? není tomu tak. Protože kyslík je více elektronegativní než vodík, přitahuje elektrony v OH vazbě k sobě. Pokud tloušťka čáry představuje hustotu elektronů (množství časových elektronů strávit v této části vazby), vazba OH ve skutečnosti vypadá spíše takto:
OBRAZ ukazující polarizaci vazby
Jak vidíte, elektrony tráví většinu času blíže k jádru kyslíku. To znamená, že kyslík je mírně záporně nabitý a že vodíky jsou mírně kladně nabité. Říká se tomu polarita a je to klíčový koncept vlastností vody
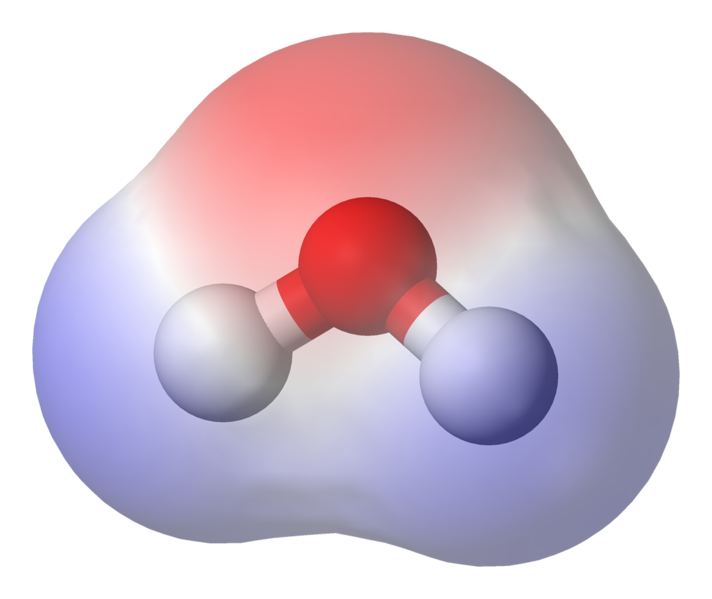
To znamená, že mezi n mohou nastat slabé iontové interakce osvěžující molekuly vody, protože mírně pozitivní vodík z jedné molekuly je přitahován k mírně negativnímu kyslíku na druhé. Říká se jim vodíkové vazby.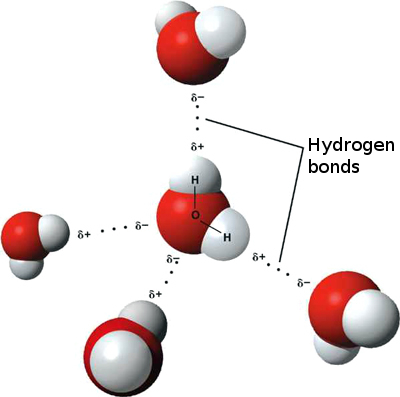
Voda se proto „lepí“ na sebe, dává jí vysoké povrchové napětí a schopnost pohybu kapilárním působením.
K rozbití vodíkových vazeb je zapotřebí velké množství energie, a proto jsou vysoké teploty tání a varu vody a má vysokou měrnou tepelnou kapacitu
Látka se bude ve vodě rozpouštět, pokud je polární nebo iontový. Je to proto, že se rozpouští tvorbou vodíkových vazeb s vodou. Ropa není polární, a proto se nerozpustí. Sůl, NaCl, se rozpouští, protože je iontová. Napadají vás nějaké další látky, které jsou rozpustné ve vodě? Jak s ním vytvářejí vodíkové vazby? Můžete nakreslit obrázek podobný obrázku níže, který ukazuje, proč je glukóza rozpustná? Je více či méně rozpustný ve vodě než sůl? Proč si myslíte, že to je?
Schéma toho, co se stane s NaCl v roztoku:
