Nociceptory lze aktivovat třemi typy stimulů v cílové tkáni – teplotní (tepelný), mechanický (např. Roztažený / namáhaný) a chemický (např. Změna pH) v důsledku lokálního zánětlivého procesu). Škodlivý stimul lze tedy rozdělit do jedné z těchto tří skupin.
Termíny nocicepce a bolest by se neměly používat synonymně, protože každá může nastat bez druhé .. Bolest vznikající při aktivaci nociceptorů se nazývá nociceptivní bolest. Nociceptivní bolest lze klasifikovat podle tkáně, ve které došlo k aktivaci nociceptoru: povrchové somatické (např. Kůže), hluboké somatické (např. Vazy / šlachy / kosti / svaly) nebo viscerální (vnitřní orgány).
Nociception pathway
Ne každý nociceptor reaguje na každý typ škodlivých podnětů. Zjevný nedostatek reakce na škodlivý stimul může být důsledkem různých receptorů umístěných na membráně koncového terminálu (volný nervový konec) nebo je intenzita stimulu nedostatečná. Prahová hodnota stimulace nociceptoru je obvykle pod intenzitou poškozující tkáň. Nociceptory mají heterogenní vlastnosti, reagují na více modalit stimulu (polymodální). Aplikace škodlivého stimulu jedné modality však může změnit vlastnosti odezvy nociceptoru na jiné modality. Rovněž aplikace konkrétního stimulu na danou dobu může vyvolat dlouhodobé změny ve vlastnostech nociceptoru. Poranění a záněty snižují prahovou hodnotu a zvyšují rozsah reakce na daný stimul, což je jev známý jako periferní senzibilizace. Obzvláště zajímavé jsou teplo reagující, ale mechanicky necitlivé nemyelinizované aferenty, které rozvíjejí mechanickou citlivost pouze v prostředí poranění.
Nociceptory mají morfologický vzhled volných nervových zakončení. Termín „volný nervový konec“ naznačuje, že ve světelném mikroskopu nelze rozpoznat žádnou (korpuskulární) receptivní strukturu. V současné době neexistují žádné jasné ultrastrukturální rozdíly mezi nenoceptivními volnými nervovými zakončeními (např. Citlivými mechanoreceptory a termoreceptory) a nociceptivními . Funkčně různá volná nervová zakončení
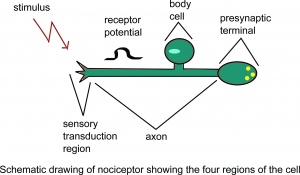
Schematický nákres nociceptoru zobrazující Předpokládá se, že čtyři oblasti buňky.
mají ve své axonální membráně různé sady receptorových molekul. Receptorové molekuly, které jsou zvláště důležité pro funkci svalových nociceptorů, jsou iontové kanály snímající kyselinu. (ASIC), které se otevírají při nízkém pH tkáně, receptory P2X3, které se aktivují vazbou adenosintrifosfátu (ATP), a podtyp receptoru přechodného podtypu 1 (TRPV1), který je citlivý na vysoké teploty, chemickou látku kapsaicinu a nízké pH. neuropeptidová látka P má Bylo zjištěno, že je přítomno převážně v nociceptivních aferentních vláknech. I když v nervovém systému existuje mnoho neurotransmiterů, třemi nejčastějšími účastníky nociceptivního přenosu jsou peptidy, puriny a excitační aminokyseliny (EAA). EAA, zejména glutamát, produkují počáteční excitační odpověď na postsynaptickém neuronu druhého řádu, následované uvolňováním peptidů, včetně látky P, což způsobuje delší prodlouženou depolarizaci a trvalý nociceptivní přenos
Jsou přítomny nociceptory v mnoha tělesných tkáních, ale nebyly nalezeny v kloubní chrupavce, viscerální pleuře, plicním parenchymu, perikardu, mozku a tkáni pupečníku.
Druhy nociceptorů
Několik tříd nociceptory byly popsány. Některé nociceptory reagují na škodlivé nachlazení, škodlivé teplo a vysoké prahové mechanické podněty i na různé chemické mediátory. Nociceptory, i když jsou polymodální, lze dále rozdělit do dvou hlavních tříd na základě reakce na mechanické podněty, což vede k rozlišení mezi mechanicky citlivými aferenty (MSA) a mechanicky necitlivými aferenty (MIA) definovanými jako aferenty, které mají velmi vysoké mechanické prahy nebo nereagují na mechanické podněty.
Nociceptory lze klasifikovat podle rychlosti vedení jejich axonů nebo průměru vláken, jedná se o skupinu III, respektive IV, respektive Aδ a C.
Myelinizované aferenty typu Aδ se středním průměrem, které zprostředkovávají akutní, dobře lokalizovanou a ostrou bolest typu pichání, známé jako aerent skupiny III. Aferentní vlákna mají průměrný průměr vláken 2 – 5 mm a vodivou rychlost 5 – 30 m / s. Aδ nociceptory lze dále rozdělit na dva typy (zdá se, že existuje přibližně 50% každého typu).
- Typ I Aδ jsou mechanicky citlivé aferenty (MSA), které reagují pomalu se přizpůsobujícím výbojem na silné přerušovaný tlak.Reagují také na tepelné a chemické podněty a mají relativně vysoké prahové hodnoty tepla (> 50C).
- nociceptory typu Aδ typu II mají nižší práh tepla než jednotky typu I, ale mají velmi vysoké mechanické prahy (nazývané mechanicky necitlivé aferenty – MIA). Činnost tohoto aferentu téměř jistě zprostředkovává „první“ reakci akutní bolesti na škodlivé teplo. Byly hlášeny v kolenním kloubu, vnitřnostech a rohovce.
Nemyelinizovaná aferentní vlákna typu C, která přenášejí špatně lokalizovaná tupá, hořící, tzv. „sekundární“ nebo pomalá bolest jsou známé jako skupina IV. Průměrný průměr vlákna je menší než 2 mm a vodivá rychlost je 2 m / s nebo méně. Nemyelinovaná vlákna C jsou také heterogenní. C aferentní vlákna C lze rozdělit do dvou tříd na základě jejich reakce na mechanické podněty. Stejně jako myelinovaná Aδ aferentní vlákna je většina vláken C polymodální, to znamená, že zahrnují populaci, která je jak mechanicky, tak tepelně citlivá (CMH). Odpověď CMH je také silně ovlivněna historií stimulů. Pozorována je jak únava, tak senzibilizace. Snížení odezvy na teplo je také pozorováno po mechanických podnětech aplikovaných na recepční pole nebo elektrických podnětech aplikovaných na nervový kmen. To naznačuje, že únavu v reakci na danou modalitu stimulu lze vyvolat heterologní stimulací, tj. Excitací stimulem jiné modality. Jedná se o převládající typ nociceptorů C-vlákna v kůži savců. Mechanicky necitlivá C vlákna (C-MIA) buď nereagují na mechanické podněty, nebo mají velmi vysokou mechanickou prahovou hodnotu. Tito aferenti reagují na teplo a různé škodlivé chemické podněty (např. Kapsaicin, histamin) a jsou často považováni za chemoreceptory.
V souhrnu k výše uvedenému je okamžitý, dobře lokalizovaný, lakomý pocit bolesti zprostředkována myelinizovanými nervovými vlákny malého průměru, typ Aδ. C vlákna zprostředkovávají špatně lokalizovaný anatomický typ bolesti, má bolavý a hořící charakter, přichází později než první první vjem a je těžké odhadnout jeho sílu.
TRP kanály
Nociceptory reagují na určitý teplotní rozsah a mechanické podněty.
Periferní konec axonu obsahuje zapouzdřené proteiny zvané transdukční proteiny (TRP), které lze aktivovat specifickým stimulem. Multigenní nadrodina přechodného receptorového potenciálu (TRP) kóduje integrální membránové proteiny, které fungují jako iontové kanály. Rodina kanálů TRP je zajímavá, protože několik členů se podílí na transdukci signálu nociceptorů.
Noceptory vláken Aδ a C detekují škodlivé chladné a škodlivé tepelné podněty. Rodina kanálů TRP poskytuje skupinu molekul vybavených pro detekci tepelných změn. Zdá se, že celý rozsah teplot, od škodlivého chladu až po škodlivé teplo, je přenášen aktivitou v těchto iontových kanálech. TRPM8 a TRPV3 / 4 kódují chladné a teplé, TRPA1 přenáší škodlivé chladu a TRPV1 / 2 snímá škodlivé teplo. Některé z termosenzitivních TRP kanálů reagují také na chemické a mechanické podněty.
Například TRPV1 je nezbytný pro transdukci nociceptivních zánětlivých a hypotermických účinků vanilloidních sloučenin a přispívá k akutní tepelné nocicepci a tepelné hyperalgézii po poranění tkáně. Proud TRPV1 je potencován bradykininem a nervovým růstovým faktorem prostřednictvím několika možných mechanismů a je také aktivován protony a kapsaicinem, „horkou“ sloučeninou v chilli papričkách. Na rozdíl od hyperalgezie po intenzivních škodlivých stimulech může dlouhodobá expozice kapsaicinu vést k následné desenzibilizaci.
Zatímco objev termosenzitivních TRP kanálů výrazně zlepšil naše chápání transdukčních mechanismů tepelných stimulů, nálezy u zvířat se selektivní delecí genů naznačují, že více a dosud neznámé transdukční mechanismy jsou zapojeny tepelnými podněty.
Chemické mediátory
Poranění vede k lokálnímu uvolňování mnoha chemikálií z jiných než neuronálních buněk (např. fibroblastů, žírných buněk, neutrofilů, monocytů a krevních destiček), jakož i ze senzorických zakončení primárních aferentních vláken které zprostředkovávají nebo usnadňují zánětlivý proces. Mezi zánětlivé mediátory patří prostaglandiny, leukotrieny, bradykinin, serotonin, histamin, SP, tromboxany, faktor aktivující trombocyty, puriny, jako je adenosin a ATP, protony a volné radikály. Cytokiny, jako jsou interleukiny a faktor nekrózy nádorů, a neurotrofiny, zejména NGF, jsou také generovány během zánětu.Za zmínku stojí, že většina těchto chemikálií (hlavně látky jako bradykinin a prostaglandin E2) se obecně považuje za neaktivující nociceptory přímo, ale spíše zvyšuje pocit bolesti v reakci na přírodní podněty a jiné endogenní chemikálie zvýšením frekvence působení potenciální střelba.
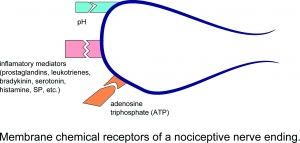
Membránové chemické receptory nociceptivního nervového zakončení.
Aktivace nociceptorů nejen přenáší aferentní zprávy do hřbetního rohu míchy, ale také iniciuje proces neurogenního zánětu. Neurogenní zánět způsobuje uvolňování neurotransmiterů, zejména látky P a peptidu souvisejícího s genem kalcitoninu (CGRP), což vede k silné vazodilataci a také k úniku plazmy z proteinů a tekutin z postkapilárních žil.
Obzvláště zajímavé jsou dvě chemikálie:
- Adenosintrifosfát (ATP)
ATP je molekula nesoucí energii. ve všech buňkách těla. Uvolňuje se ze všech tkání během traumatu a dalších patologických změn, které jsou spojeny se smrtí buněk. Z tohoto důvodu byla ATP považována za obecnou signální látku pro traumata a bolesti tkání. V lidských mikroneurografických studiích injekce ATP aktivovala 60% mechanicky citlivých a mechanicky necitlivých C-nociceptivních vláken bez senzitizace těchto vláken na mechanické nebo tepelné podněty. ATP aktivuje purinergní receptory P2X3 v nociceptorech a způsobuje výtok. ATP je zvláště důležitý pro svalovou bolest, protože je přítomný ve svalových buňkách ve vysoké koncentraci.
- Změna protonů v pH tkáně
Kyselinové iontové kanály (ASIC) tvoří rodinu receptorových molekul, které jsou citlivé na pokles pH a otevřené při různých hodnotách pH. Proteiny kanálu reagují již na příliš malé změny pH. Tato rodina receptorů (například ASIC1 a ASIC3) je zvláště důležitá pro bolesti svalů, protože téměř všechny patologické změny ve svalech jsou doprovázeny poklesem pH tkáně, např. Vyčerpávajícím cvičením, ischemií a zánětem.
Umístění nociceptorů
Buněčná těla nociceptorů jsou umístěna v gangliích dorzálních kořenů (DRG) pro periferii a trigeminálním ganglionu pro obličej. Jejich axony sahají do periferního nervového systému a končí ve větvích vytvářejících receptivní pole.
- Kůže
Volná nervová zakončení končící v kůži jsou mechanizmem pro signalizaci místních mechanických, tepelných a chemických změn. Velká většina volných nervových zakončení v kůži se nazývá polymodální nociceptory, protože obsahují více receptorů a reagují tak na různé kombinace výše zmíněného stimulu. Vysokoprahové jednotky mechanoreceptorů typu I Aδ jsou hustě distribuovány ve chlupaté a lysé kůži.
- Svaly
Receptorové molekuly, které jsou zvláště důležité pro funkcí svalových nociceptorů jsou iontové kanály snímající kyselinu (ASIC), které se otevírají při nízkém pH tkáně, receptory P2X3, které jsou aktivovány vazbou adenosintrifosfátu (ATP), a přechodný receptorový potenciální podtyp receptoru 1 (TRPV1), který je citlivý na vysoké teploty a nízké pH.
V kosterním svalu se zdá, že jsou volná nervová zakončení distribuována docela rovnoměrně. Nebyl nalezen žádný rozdíl mezi proximální a distální částí svalu potkana gastrocnemius – soleus. Ve stejné studii však bylo zjištěno, že hustota nervových vláken v peritendinu šlachy šlachy potkana je několikrát vyšší než v GS svalu. Naproti tomu svazky kolagenových vláken vlastní tkáně šlachy byly téměř bez volných nervových zakončení.
- Šlachy
Inervace lidských Achillových šlach je poskytován nervy z okolních svalů a malými fasciculi z kožních nervů, ale to zahrnuje všechny nervové zakončení. Volná nervová zakončení jsou zastoupena uvnitř šlach, ale hlavně v peritendinózní tkáni jsou receptory bolesti. Počet a umístění všech nervových vláken a nervových zakončení se liší podle funkce šlachy, přičemž jsou více zastoupeny v menších šlachách zapojených do jemných pohybů.
- Kloub
Nociceptory v kloubech se nacházejí uvnitř kloubního pouzdra, vazů a proximálních šlach, kostí, periostu, kloubního tukového polštářku a kolem krevních cév, nikoli však v kloubní chrupavce. Vysokoprahové nociceptivní aferenty končí primárně v synoviu a periostu a normálně reagují pouze na pohyb kloubu za pracovní limity. Po poškození kloubů se dva faktory kombinují a mění mechanickou citlivost kloubních nociceptorů.Zaprvé fyzikální změny (kloubní výpotek a otoky tkání) mění klidové a pohybem vyvolané síly vyvíjené na kloubní tkáně a zadruhé, zánětlivé mediátory uvolněné v poškozené tkáni senzibilizují artikulární nociceptivní aferenty vazbou na receptory na nervových zakončeních. Mnoho nociceptorů kloubu reaguje na neškodné pohyby, ale stále více se aktivují, když pohyby přesahují fyziologický pracovní rozsah, zatímco jiné nociceptory jsou aktivní výlučně během škodlivých pohybů. Třetí skupina takzvaných tichých nociceptorů je obvykle neaktivní a reaguje pouze za patologických okolností, jako jsou záněty.
Bylo prokázáno, že kloubní pouzdro bederního fazetu je bohatě inervováno nociceptory a proprioceptivními vlákny. V normálním stavu mají nociceptory, jako jsou ty, které se objevují ve fazetové kloubní tobolce, vysokou prahovou hodnotu a neočekává se, že by se uvolnily, pokud by zátěže nebyly suprapyziologické. Avšak v přítomnosti patologického zánětu kloubu mohou chemické mediátory synovitidy tyto nociceptory senzibilizovat a ke stimulaci bolesti již nemusí být zapotřebí suprapyziologické hladiny stresu. Takové zánětlivé mediátory (látka P, bradykinin, fosfolipáza A2) byly detekovány ve fazetovém kloubním pouzdře.
Nociceptory v meziobratlových ploténkách jsou obvykle omezeny na vnější třetinu mezikruží, může to být substrát pro diskogenní bolest, když jsou rozšířeny přes větší prstencovou oblast a pronikají dále do zdegenerovaného disku podél vaskulatury a poranění. Tito vlákna C- a A δ jsou pravděpodobně zodpovědní za přenos bolestivých odpovědí. Zadní podélné vazy a vnější mezikruží – meziobratlové ploténky obsahují spoustu nociceptivních vláken. Nervová vlákna a nervová zakončení se také vyskytují v subchondrální kosti zygapofyziálních kloubů. Vyskytují se v erozních kanálech sahajících od subchondrální kosti po kloubní chrupavku.
Studie na lidech (Kiter et al., 2010) prokázala jak volná, tak zapouzdřená nervová zakončení v lidském iliolumbálním vazu. Studie (Hirsch et al., 1963) navrhl přítomnost jemných nervových vláken a komplexních nezapouzdřených zakončení v supraspinálních a intraspinálních vazech.
- Viscera
Viscerální nociceptory nereagují na poranění řezáním nebo pálením jako jejich protějšky v periferní kožní tkáni. Místo toho se aktivují v reakci na patologické změny. Podněty produkující bolest ve vnitřních orgánech, včetně trakce na mezenterii, zánětu, distenze dutých svalových orgánů, jako jsou gastrointestinální, močové cesty, žlučník, a silných kontrakcí svalových vrstev obklopujících tyto duté orgány, chemických dráždivých látek nebo ischemie v orgánech, jako je srdce. Distribuce těchto vláken se mezi orgány liší. Vysokoprahové receptory inervují výhradně orgány, z nichž je bolest jediným vědomým pocitem (tj. Močovod, ledviny, plíce, srdce), ale relativně málo jich je v orgánech poskytujících neškodné a škodlivé pocity (např. Tlusté střevo, žaludek a močový měchýř) inervováno většinou nízkoprahovými receptory. Orgány, jako jsou játra, plíce, ledviny a slinivka břišní, mají málo receptorů, ale bolest z těchto orgánů pochází většinou z aktivace receptorů v kapslích těchto orgánů. Nociceptivní stimulace vnitřností vede k rozptýlené bolesti, kterou je obtížné lokalizovat. Aferentní nociceptivní vlákna ve vnitřnostech se nacházejí ve spojení se sympatickými a parasympatickými nervy. Většina viscerálních orgánů je inervována vagovým nervem, ale studie jasně neukazují, zda je tento nerv schopen nést nociceptivní aferentní vstup. Některé studie však jasně ukazují, že vagální aferenti předávají informace o mechanických podnětech s vysokou intenzitou do centrálního nervového systému. Řada studií zahrnujících lidi nebo zvířata ukázala, že subjekty s poškozením páteře mohou hlásit bolest pravděpodobně pocházející z oblasti vnitřních orgánů.
- 1.0 1.1 Loeser JD, Treede RD. Kjótský protokol IASP Základní terminologie bolesti. Bolest. 2008; 137 (3): 473–7. doi: 10.1016 / j.pain.2008.04.025. PMID 18583048
- Basbaum AI, Jessell T. Vnímání bolesti. In: Kandel ER, Schwartz J, redaktoři Jessell T. Principy neurovědy. New York: Appleton a Lange; 2000. p472-491
- 3,0 3,1 3,2 3,3 3,4 3,5 Meyer RA, Ringkamp M, Campbell JN, Raja SN. Periferní mechanismy kožní nocicepce. In: McMahon SB, Koltzenburg M, redaktoři. Wall a Melzackova učebnice bolesti. Londýn: Elsevier; 2006. p3–34.
- Lloyd DPC. Neuronové vzorce kontrolující přenos ipsilaterálních reflexů zadní končetiny u kat. J. Neurophysiol. 1943; 6: 293–315
- 5,0 5,1 5,2 Schaible HG, Schmidt RF. Účinky experimentální artritidy na senzorické vlastnosti jemných artikulárních aferentních jednotek. Journal of Neurophysiology. 1985; 54: 1109-1122
- Häbler HJ, Jänig W, Koltzenburg M.Nový typ nemyelinizovaného chemosenzitivního nociceptoru v akutně zaníceném močovém měchýři. Agenti a akce. 1988; 25: 219-221
- Tanelian DL. Cholinergní aktivace populace aferentních nervů rohovky. Experimentální výzkum mozku. 1991; 86: 414-420
- LaMotte RH, Campbell JN. Srovnání odpovědí teplých a nociceptivních aferentních vláken C u opice s lidskými úsudky o tepelné bolesti. Journal of Neurophysiology. 1978; 41: 509-528
- Treede RD, Meyer RA, Raja SN, Campbell JN. Důkazy o dvou různých mechanismech přenosu tepla v nociceptivních primárních aferentech, které inervují kůži opice. Fyziologický časopis. 1995; 483: 747-758
- Schepers RJ, Ringkamp M. Termoreceptory a termosenzitivní aferenty. Neurovědy & Biobehhaviorální recenze. 2010; 34 (2): 177-184
- Caterina MJ, Schumacher MA, Tominaga M, Rosen TA, Levine JD, Julius D. Receptor kapsaicinu: tepelně aktivovaný iontový kanál v cestě bolesti. Nature 1997; 389: 816–824
- Bjur D, Alfredson H, Forsgren S. Inervační vzor lidské Achillovy šlachy: studie normální a tendinózové šlachy se značkami pro obecnou a smyslovou inervaci. Cell Tissue Res. 2005; 320: 201-206
- 13,0 13,1 Ashton IK, Ashton BA, Gibson SJ, Polak JM, Jaffray DC, Eisenstein SM. Morfologický základ pro bolesti zad: demonstrace nervových vláken a neuropeptidů v kloubním pouzdru bederní fazety, ale ne v ligamentum fl avum. J Orthop Res. 1992; 10 (1): 72-78
- Kiter E, Karaboyun T, Tufan AC, Acar K. ImmunohistochemicalfckLR demonstrace volných nervových zakončení v iliolumbálním vazu. Páteř. 2010; 35 (4): E101-4. doi: 10.1097 / BRS.0b013e3181ae561d.
- Hirsch C, Ingelmark BE, Miller M. Anatomický základ bolesti lowfckLRback. Studie na přítomnost zakončení senzorických nervů ovlivňují strukturální, kapsulární a meziobratlové ploténky v lýtkové bederní páteři. Acta Orthop Scand. 1963; 33: 1–17.
- Moller, Aage (2014-04-22). Bolest, její anatomie, fyziologie a léčba. Kindle vydání.
