Cíle učení
- Psát chemické rovnice pro vodu, která působí jako kyselina a jako báze.
Voda (H2O) je v mnoha ohledech zajímavá sloučenina. Zde budeme uvažovat o jeho schopnosti chovat se jako kyselina nebo báze.
Za určitých okolností molekula vody přijme proton a bude tedy působit jako Brønsted-Lowryho báze. Viděli jsme příklad v rozpouštění HCl v H2O:
\
Za jiných okolností může molekula vody darovat proton, a tak působit jako kyselina Brønsted-Lowry. Například za přítomnosti amidového iontu (viz příklad 4 v části 10.2) daruje molekula vody proton, který jako produkt vytvoří amoniak:
\
V tomto případě , NH2− je Bronsted-Lowryho báze (akceptor protonů).
Takže, v závislosti na okolnostech, může H2O působit buď jako Bronsted-Lowryho kyselina nebo jako Bronsted-Lowryho báze. Voda není jedinou látkou, která může v některých případech reagovat jako kyselina nebo v jiných jako báze, ale je to určitě nejběžnější příklad – a ten nejdůležitější. Látka, která může darovat nebo přijímat proton, se podle okolností nazývá amfiprotická sloučenina.
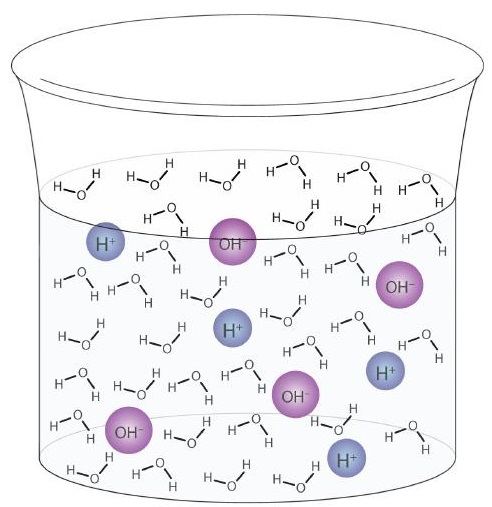
Molekula vody může působit jako kyselina nebo báze i ve vzorku čisté vody. Asi 6 z každých 100 milionů (6 ze 108) molekul vody podstoupí následující reakci:
\
Tento proces se nazývá autoionizace vody (obrázek \ (\ PageIndex {1}) \)) a vyskytuje se v každém vzorku vody, ať už je čistá nebo je součástí roztoku. K autoionizaci dochází do určité míry v jakékoli amfiprotické kapalině. (Pro srovnání, kapalný amoniak také podléhá autoionizaci, ale pouze asi 1 molekula z milionu miliard (1 z 1015) reaguje s jinou molekulou amoniaku.)
Cvičení kontroly konceptu
- Vysvětlete, jak může voda působit jako kyselina.
- Vysvětlete, jak může voda působit jako báze.
Odpovědi
- Za správných podmínek může H2O darovat proton, což z něj činí kyselinu Brønsted-Lowry.
- Za správných podmínek může H2O přijmout proton, což z ní dělá Brønsted-Lowry báze.
Klíčové vlastnosti
- Molekuly vody mohou působit jako kyselina i báze, v závislosti na podmínky.
