Inlärningsmål
- Att skriva kemiska ekvationer för vatten som fungerar som en syra och som en bas.
Vatten (H2O) är en intressant förening i många avseenden. Här kommer vi att överväga dess förmåga att bete sig som en syra eller en bas.
Under vissa omständigheter kommer en vattenmolekyl att acceptera en proton och därmed fungera som en Brønsted-Lowry-bas. Vi såg ett exempel vid upplösning av HCl i H2O:
\
Under andra omständigheter kan en vattenmolekyl donera en proton och därmed fungera som en Brønsted-Lowry-syra. I närvaro av amidjonen (se exempel 4 i avsnitt 10.2) donerar en vattenmolekyl en proton, vilket gör ammoniak som en produkt:
\
I detta fall NH2− är en Brønsted-Lowry-bas (protonacceptorn).
Så beroende på omständigheterna kan H2O fungera antingen som en Brønsted-Lowry-syra eller en Brønsted-Lowry-bas. Vatten är inte det enda ämnet som kan reagera som en syra i vissa fall eller en bas i andra, men det är verkligen det vanligaste exemplet – och det viktigaste. Ett ämne som antingen kan donera eller acceptera en proton, beroende på omständigheterna, kallas en amfiprotisk förening.
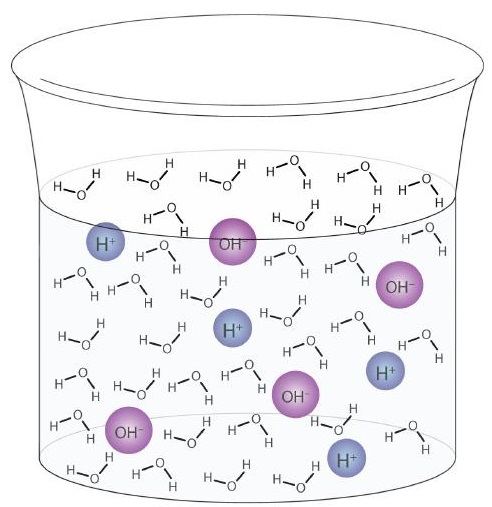
En vattenmolekyl kan fungera som en syra eller en bas även i ett prov av rent vatten. Cirka 6 av 100 miljoner (6 av 108) vattenmolekyler genomgår följande reaktion:
\
Denna process kallas autojonisering av vatten (Figur \ (\ PageIndex {1}) \)) och förekommer i varje vattenprov, oavsett om det är rent eller en del av en lösning. Autojonisering sker till viss del i någon amfiprotisk vätska. (Som jämförelse genomgår också flytande ammoniak autojonisering, men endast cirka en molekyl av en miljon miljarder (1 av 1015) reagerar med en annan ammoniakmolekyl.)
Konceptöversiktsövningar
- Förklara hur vatten kan fungera som en syra.
- Förklara hur vatten kan fungera som en bas.
Svar
- Under rätt förhållanden kan H2O donera en proton, vilket gör den till en Brønsted-Lowry-syra.
- Under rätt förhållanden kan H2O acceptera en proton, vilket gör den till en Brønsted-Lowry bas.
Key Takeaway
- Vattenmolekyler kan fungera som både en syra och en bas, beroende på villkoren.
