Newsflash
O newsflash interrompe seu programa de TV favorito. “Houve um assalto no First National Bank. O suspeito fugiu em um carro e acredita-se que esteja em algum lugar no centro da cidade. Todos devem estar alertas.” O ladrão pode ser localizado apenas dentro de uma determinada área – a polícia não tem uma localização exata, apenas uma ideia geral sobre o paradeiro do ladrão.
Em 1926, O físico austríaco Erwin Schrödinger (1887–1961) usou a dualidade onda-partícula do elétron para desenvolver e resolver uma equação matemática complexa que descreveu com precisão o comportamento do elétron em um átomo de hidrogênio. O modelo mecânico quântico do átomo vem da solução à equação de Schrödinger. A quantização das energias do elétron é um requisito para resolver a equação. Isso é diferente do modelo de Bohr, no qual a quantização era simplesmente assumida sem nenhuma base matemática.
Lembre-se de que, no modelo de Bohr, o caminho exato do elétron era restrito a órbitas circulares muito bem definidas em torno do núcleo. O modelo da mecânica quântica é uma mudança radical disso. As soluções para a equação de onda de Schrödinger, chamadas funções de onda, fornecem apenas a probabilidade de encontrar um elétron em um determinado ponto ao redor do núcleo. Elétrons não viajam ao redor do núcleo em órbitas circulares simples.
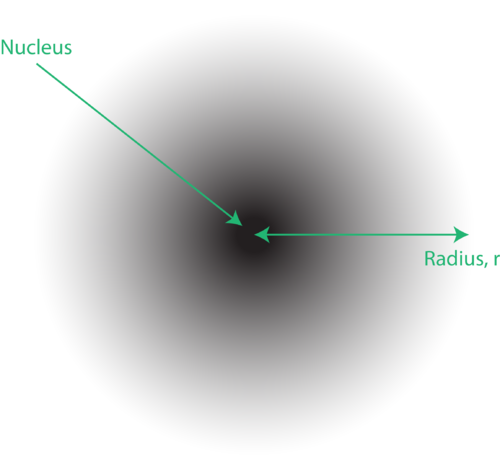
Figura 1. Um nuvem de elétrons: a região mais escura próxima ao núcleo indica uma alta probabilidade de encontrar o elétron, enquanto a região mais clara mais distante do núcleo indica uma probabilidade menor de encontrar o elétron.
A localização dos elétrons no modelo da mecânica quântica do átomo costuma ser chamada de nuvem de elétrons. A nuvem de elétrons pode ser pensada da seguinte maneira: Imagine colocar um pedaço de papel quadrado no chão com um ponto no círculo representando o núcleo. Agora pegue um marcador e solte-o no papel repetidamente, fazendo pequenas marcas em cada ponto que o marcador atingir. Se você soltar o marcador muitas e muitas vezes, o padrão geral de pontos será aproximadamente circular. Se você apontar para o centro razoavelmente bem, haverá mais pontos perto do núcleo e progressivamente menos pontos conforme você se afasta dele. Cada ponto representa um local onde o elétron poderia estar a qualquer momento. Por causa do princípio da incerteza, não há como saber exatamente onde o elétron está. Uma nuvem de elétrons tem densidades variáveis: uma alta densidade onde o elétron é mais provável e uma baixa densidade onde o elétron é menos provável de estar (Figura 1).
Para definir especificamente a forma de a nuvem, é comum referir-se à região do espaço dentro da qual há 90% de probabilidade de encontrar o elétron. Isso é chamado de orbital, a região tridimensional do espaço que indica onde há uma alta probabilidade de encontrar um elétron.
Resumo
- A onda de Schrödinger a equação substituiu as idéias de Bohr sobre a localização do elétron por um fator de incerteza.
- A localização do elétron só pode ser dada como uma probabilidade de que o elétron esteja em algum lugar em uma determinada área.
Prática
Use o link abaixo para responder às seguintes perguntas:
http://science.howstuffworks.com/atom8.htm
- Qual era o problema com o modelo de átomo de Bohr?
- O que Heisenberg mostrou sobre elétrons?
- O que Schrödinger derivou?
Revisão
- O que a visão mecânica quântica do átomo requer?
- O que é uma função de onda?
- O que sugere uma nuvem de elétrons de alta densidade?
Glossário
- nuvem de elétrons: a localização do elétrons no modelo da mecânica quântica do átomo.
- orbital: a região tridimensional do espaço que indica onde há uma alta probabilidade de encontrar um elétron.
- modelo da mecânica quântica: um modelo de o átomo que deriva da equação de onda de Schrödinger e lida com probabilidades.
- função de onda: forneça apenas a probabilidade de encontrar um elétron em um determinado ponto ao redor do núcleo.
