Wiadomości
Wiadomości przerywają Twój ulubiony program telewizyjny. „Doszło do zatrzymania w Pierwszym Banku Narodowym. Podejrzany uciekł samochodem i uważa się, że przebywa gdzieś w centrum miasta. Wszyscy proszeni są o zachowanie czujności”. Złodziej może znajdować się tylko na określonym obszarze – policja nie ma dokładnej lokalizacji, a jedynie ogólne pojęcie o miejscu pobytu złodzieja.
W 1926 roku Austriacki fizyk Erwin Schrödinger (1887–1961) wykorzystał dualizm falowo-cząsteczkowy elektronu, aby opracować i rozwiązać złożone równanie matematyczne, które dokładnie opisało zachowanie elektronu w atomie wodoru. Kwantowo-mechaniczny model atomu pochodzi z rozwiązania do równania Schrödingera. Kwantyzacja energii elektronów jest wymagana do rozwiązania równania. W przeciwieństwie do modelu Bohra, w którym kwantyzację po prostu założono bez matematycznej podstawy.
Przypomnijmy, że w modelu Bohra dokładna ścieżka elektronu została ograniczona do bardzo dobrze określonych orbit kołowych wokół jądra. Model mechaniki kwantowej jest radykalnym odstępstwem od tego. Rozwiązania równania falowego Schrödingera, zwane funkcjami falowymi, dają jedynie prawdopodobieństwo znalezienia elektronu w danym punkcie wokół jądra. Elektrony nie krążą wokół jądra po prostych orbitach kołowych.
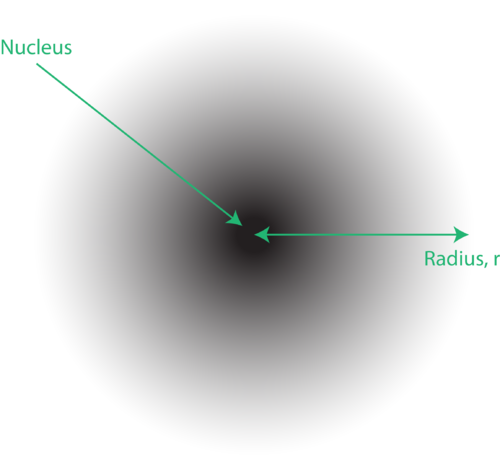
Rysunek 1. An chmura elektronów: ciemniejszy obszar bliżej jądra wskazuje na wysokie prawdopodobieństwo znalezienia elektronu, podczas gdy jaśniejszy region dalej od jądra wskazuje na mniejsze prawdopodobieństwo znalezienia elektronu.
Lokalizacja elektronów w mechanicznym modelu kwantowym atomu jest często nazywana chmurą elektronów. O chmurze elektronów można myśleć w następujący sposób: Wyobraź sobie, że kładziesz na podłodze kwadratową kartkę papieru z kropką w okręgu reprezentującą jądro. Teraz weź marker i kilkakrotnie upuść go na papierze, robiąc małe znaki w każdym punkcie trafienia markera. Jeśli wiele razy upuścisz znacznik, ogólny wzór kropek będzie mniej więcej okrągły. Jeśli dość dobrze wycelujesz w środek, w pobliżu jądra będzie więcej kropek i będzie ich coraz mniej, gdy będziesz się od niego oddalać. Każda kropka reprezentuje miejsce, w którym elektron może znajdować się w dowolnym momencie. Ze względu na zasadę nieoznaczoności nie ma możliwości dokładnego ustalenia, gdzie znajduje się elektron. Chmura elektronów ma zmienną gęstość: wysoką gęstość, w której elektron jest najbardziej prawdopodobny, i niską, gdzie elektron jest najmniej prawdopodobny (Rysunek 1).
Aby konkretnie zdefiniować kształt elektronu chmura, zwyczajowo odnosi się do obszaru przestrzeni, w którym istnieje 90% prawdopodobieństwo znalezienia elektronu. Nazywa się to orbitalem, trójwymiarowym obszarem przestrzeni, który wskazuje, gdzie istnieje duże prawdopodobieństwo znalezienia elektronu.
Podsumowanie
- Fala Schrödingera równanie zastąpiło idee Bohra dotyczące lokalizacji elektronu współczynnikiem niepewności.
- Położenie elektronu można podać jedynie jako prawdopodobieństwo, że elektron znajduje się gdzieś w określonym obszarze.
Ćwicz
Użyj poniższego łącza, aby odpowiedzieć na następujące pytania:
http://science.howstuffworks.com/atom8.htm
- Jaki był jeden problem z modelem atomu Bohra?
- Co Heisenberg pokazał na temat elektronów?
- Co wyprowadził Schrödinger?
Recenzja
- Czego wymaga kwantowa mechanika widzenia atomu?
- Co to jest funkcja falowa?
- Co sugeruje chmura elektronów o dużej gęstości?
Glosariusz
- chmura elektronów: lokalizacja elektrony w kwantowy model mechaniczny atomu.
- orbital: trójwymiarowy obszar przestrzeni, który wskazuje, gdzie istnieje duże prawdopodobieństwo znalezienia elektronu.
- model mechaniki kwantowej: model atom pochodzący z równania falowego Schrödingera i zajmujący się prawdopodobieństwami.
- funkcja falowa: podaj tylko prawdopodobieństwo znalezienia elektronu w danym punkcie wokół jądra.
