Nieuwsflits
De nieuwsflits onderbreekt je favoriete tv-programma. “Er is een overval geweest bij de Eerste Nationale Bank. De verdachte is in een auto gevlucht en wordt verondersteld ergens in de binnenstad te zijn. Iedereen wordt gevraagd op hun hoede te zijn.” De overvaller kan alleen binnen een bepaald gebied worden gelokaliseerd – de politie heeft geen exacte locatie, alleen een algemeen idee van de verblijfplaats van de dief.
In 1926 De Oostenrijkse natuurkundige Erwin Schrödinger (1887–1961) gebruikte de dualiteit van golf en deeltje van het elektron om een complexe wiskundige vergelijking te ontwikkelen en op te lossen die het gedrag van het elektron in een waterstofatoom nauwkeurig beschrijft. Het kwantummechanische model van het atoom komt uit de oplossing. volgens de vergelijking van Schrödinger. Kwantisering van elektronenenergieën is een vereiste om de vergelijking op te lossen. Dit is in tegenstelling tot het Bohr-model, waarin kwantisering eenvoudigweg werd aangenomen zonder wiskundige basis.
Bedenk dat in het Bohr-model het exacte pad van het elektron was beperkt tot zeer goed gedefinieerde cirkelvormige banen rond de kern. Het kwantummechanische model wijkt daar radicaal van af. Oplossingen voor de Schrödingergolfvergelijking, golffuncties genaamd, geven alleen de kans om een elektron te vinden op een bepaald punt rond de kern. Elektronen reizen niet rond de kern in eenvoudige cirkelvormige banen.
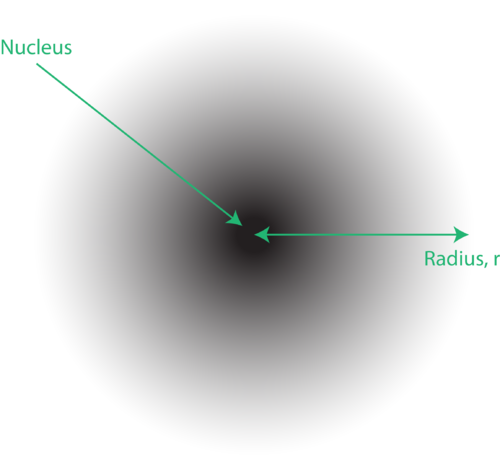
Figuur 1. Een elektronenwolk: het donkere gebied dichter bij de kern duidt op een grote kans om het elektron te vinden, terwijl het lichtere gebied verder van de kern duidt op een kleinere kans om het elektron te vinden.
De locatie van de elektronen in het kwantummechanische model van het atoom wordt vaak een elektronenwolk genoemd. De elektronenwolk kan op de volgende manier worden gezien: Stel je voor dat je een vierkant stuk papier op de grond legt met een stip in de cirkel die de kern voorstelt. Neem nu een marker en laat deze herhaaldelijk op het papier vallen, waarbij je kleine markeringen maakt op elk punt dat de marker raakt. Als u de markering heel vaak laat vallen, zal het algehele patroon van stippen ongeveer cirkelvormig zijn. Als je redelijk goed naar het midden mikt, zullen er meer stippen in de buurt van de kern zijn en geleidelijk minder stippen naarmate je er verder vanaf beweegt. Elke stip vertegenwoordigt een locatie waar het elektron zich op een bepaald moment zou kunnen bevinden. Vanwege het onzekerheidsprincipe is er geen manier om precies te weten waar het elektron zich bevindt. Een elektronenwolk heeft variabele dichtheden: een hoge dichtheid waar het elektron het meest waarschijnlijk zal zijn en een lage dichtheid waar het elektron zich het minst waarschijnlijk zal bevinden (Figuur 1).
Om specifiek de vorm van de wolk, is het gebruikelijk om te verwijzen naar het gebied van de ruimte waarbinnen de kans 90% is om het elektron te vinden. Dit wordt een orbitaal genoemd, het driedimensionale gebied van de ruimte dat aangeeft waar de kans groot is om een elektron te vinden.
Samenvatting
- De Schrödingergolf vergelijking verving de Bohr-ideeën over elektronenlocatie door een onzekerheidsfactor.
- De locatie van het elektron kan alleen worden gegeven als een waarschijnlijkheid dat het elektron zich ergens in een bepaald gebied bevindt.
Oefenen
Gebruik de onderstaande link om de volgende vragen te beantwoorden:
http://science.howstuffworks.com/atom8.htm
- Wat was een probleem met het Bohr-model van het atoom?
- Wat liet Heisenberg zien over elektronen?
- Wat heeft Schrödinger afgeleid?
Review
- Wat vereist de kwantummechanische kijk op het atoom?
- Wat is een golffunctie?
- Wat suggereert een elektronenwolk met een hoge dichtheid?
Woordenlijst
- elektronenwolk: de locatie van de elektronen in de kwantummechanisch model van het atoom.
- orbitaal: het driedimensionale gebied van de ruimte dat aangeeft waar de kans groot is om een elektron te vinden.
- kwantummechanisch model: een model van het atoom dat is afgeleid van de golfvergelijking van Schrödinger en handelt over waarschijnlijkheden.
- golffunctie: geef alleen de kans om een elektron te vinden op een bepaald punt rond de kern.
