Perché la gente dice che l’acqua è necessaria per la vita? Perché non abbiamo mai trovato alcun organismo vivente che possa prosperare in un ambiente completamente asciutto? Come mai qualcosa di inodore, incolore, insapore e relativamente poco reattivo costituisce il 60% della nostra massa corporea? Perché non è stato possibile utilizzare un altro liquido? Perché l’acqua?
L’acqua ha diverse proprietà che la rendono unica tra i composti e rendono possibile il funzionamento di tutte le forme di vita conosciute.
È l’unica sostanza naturale che si trova in tutti e tre gli stati fisici alle temperature che si verificano naturalmente sulla Terra.
Ciò significa che vediamo l’acqua come un liquido, nei fiumi e nei mari, come un solido, come la neve e il ghiaccio, e come un gas, come le nuvole o il vapore. Se così non fosse, il ciclo dell’acqua sarebbe completamente diverso (e se l’acqua non evaporasse al sole?); La neve e il ghiaccio potrebbero non esistere (e migliaia di specie sarebbero ora senzatetto) e il tempo sarebbe molto diverso ( pioverebbe ancora?). Riesci a pensare a qualcos’altro che sarebbe diverso? Pensi che potremmo ancora vivere se l’acqua fosse solo un liquido alle temperature che si verificano naturalmente sulla Terra? E solo un gas / solido?
Il ghiaccio è meno denso dell’acqua
Ciò significa semplicemente che il ghiaccio galleggia sull’acqua e che i laghi si congelano dall’alto verso il basso. Questo è chiaramente importante per gli animali che vivono sul ghiaccio, poiché i loro habitat sarebbero notevolmente ridotti o non esisterebbero se il ghiaccio affondasse. Allo stesso modo, i pesci e altri laghetti sarebbero influenzati se i laghi e gli stagni si congelassero dal basso verso l’alto: lo strato di acqua ghiacciata nella parte superiore dello stagno fornisce un po Lo fa creando una barriera tra il freddo l’aria e l’acqua sotto. Ciò significa che i grandi specchi d’acqua non si raffreddano più in profondità più velocemente che potrebbero se il ghiaccio affonda e aiuta la fauna selvatica a sopravvivere negli stagni durante l’inverno. Infatti, l’acqua diventa più densa quando viene raffreddata fino a raggiungere $ 4 ^ \ circ $ C (che puoi vedere nel grafico), dopodiché diventa di nuovo meno denso. La maggior parte delle sostanze diventa progressivamente più densa man mano che vengono raffreddate. Il grafico sotto mostra come la densità dell’acqua cambia con la temperatura.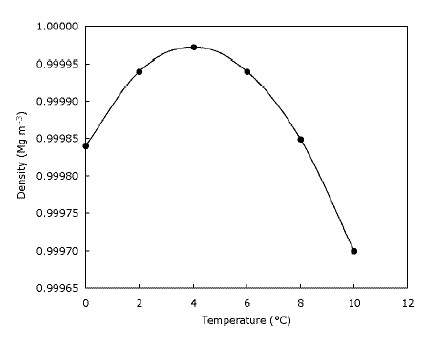
L’acqua ha un punto di fusione e di ebollizione molto alto rispetto ad altre molecole simili
Questo è ciò che significa che è vista come un solido, un liquido e un gas sulla Terra. Se l’acqua non fosse un liquido alla maggior parte delle temperature che vediamo sulla Terra i mari sarebbero tutti di ghiaccio, non ci sarebbe pioggia, niente da raccogliere per le piante e da bere per gli animali. Anche le nostre cellule sono piene di acqua liquida, cosa che non sarebbe possibile.
Si chiama “solvente universale” perché è in grado di sciogliere tante sostanze.
L’acqua nel nostro corpo i È contenuto per lo più nelle nostre cellule, dove conferisce loro una forma chiara oltre ad avere miliardi di molecole utili disciolte in esso. Le nostre cellule hanno bisogno di essere riempite d’acqua per funzionare correttamente perché gli enzimi al loro interno funzionano solo in soluzione. L’acqua è anche il mezzo attraverso il quale il trasporto avviene nel nostro corpo “il sangue è principalmente acqua e contiene ormoni e gas disciolti e tossine come l’urea, che vengono rimosse dal corpo con ancora più acqua. Il trasporto in acqua avviene anche su un scala molto più piccola: quando qualcosa si scioglie può muoversi nel solvente. Ad esempio, se un enzima ha bisogno di ioni calcio per essere attivato e iniziare a funzionare, li incontrerà mentre si muovono nella soluzione all’interno di una cellula. Maggiore è la concentrazione di calcio nella cellula, più è probabile che l’enzima incontri uno ione prima. Potresti anche aver imparato a conoscere la diffusione e l’osmosi, che sono concetti chiave per capire come funzionano le cellule e dipendono dalla presenza di acqua
L’acqua ha un alto valore specifico capacità termica.
Anche se questa idea sembra un po ‘intimidatoria, in realtà è molto semplice: tutto ciò significa che ci vuole molta energia per rendere l’acqua un po’ più calda. Questo è il motivo per cui in una giornata calda la sabbia su una spiaggia può essere troppo caldo per camminare ma il mare è ancora fresco; l’energia del sole è sufficiente per riscaldare molto la sabbia ma l’acqua poco. Ciò ha alcune implicazioni molto importanti, specialmente per gli organismi che vivono nell’acqua. Mari, laghi e fiumi mantengono una temperatura molto più costante dell’aria, il che significa che gli animali possono vivere in acqua tutto l’anno senza doversi adattare a grandi sbalzi di temperatura (cosa pensi che accadrebbe se l’acqua si raffreddasse più facilmente? Quali problemi potrebbe questo posa agli organismi che vivono in un piccolo stagno?). Ciò significa anche che la temperatura corporea è ragionevolmente difficile da cambiare rapidamente e quindi rende molto più facile il compito del nostro cervello di mantenere una temperatura corporea costante (cosa potrebbe accadere se la nostra temperatura corporea cambiasse rapidamente e facilmente?).
Tensione superficiale
Avrai notato che se metti un ago sulla superficie di una ciotola d’acqua galleggia ma se lo butti dentro affonda.Questo perché l’ago è più denso dell’acqua, quindi vuole affondare ma è trattenuto dalla tensione superficiale dell’acqua. La tensione superficiale è una proprietà che significa che la superficie dell’acqua non vuole rompersi – è “appiccicosa”. Puoi anche vederlo quando riempi una tazza fino all’orlo, poiché la superficie dell’acqua si terrà unita e resisterà alla fuoriuscita. L’elevata tensione superficiale dell’acqua è il motivo per cui alcune mosche possono atterrare sulla sua superficie senza affondare. Questo concetto è anche strettamente correlato a un altro, l’idea di azione capillare.
Azione capillare
Analogamente alla tensione superficiale, questo ruota attorno all’idea che le molecole di acqua “aderiscano” insieme. Se metti un tubo molto sottile in un bicchiere d’acqua, vedrai che una parte dell’acqua viaggia per un breve tratto nel tubo; questa si chiama azione capillare ed è causata dall’acqua che aderisce ai lati del tubo e ad altre molecole d’acqua, trascinandole con sé nel tubo. Alla fine il peso dell’acqua che viene tirata è troppo grande per essere sostenuto e l’acqua smette di muoversi, avendo raggiunto un equilibrio. Questo stesso principio consente alle piante di attingere l’acqua dal terreno; man mano che le molecole d’acqua viaggiano lungo lo stelo, più molecole d’acqua si attaccano a loro e più si attaccano a quelle e così via fino a quando una colonna d’acqua viene trasportata nello xilema (per saperne di più, cerca “traspirazione”).
Ma perché?
Tutte queste proprietà dell’acqua sono fondamentali per la vita così come la conosciamo, ma perché l’acqua le possiede? Nessun’altra sostanza fa anche queste cose? Cos’è l’acqua che la rende diversa? Per capire le risposte a queste domande devi studiare la struttura molecolare dell’acqua. La formula chimica dell’acqua è H2O, il che significa che contiene due atomi di idrogeno legati in modo covalente a un atomo di ossigeno, in questo modo: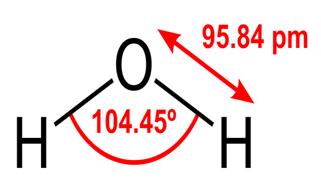
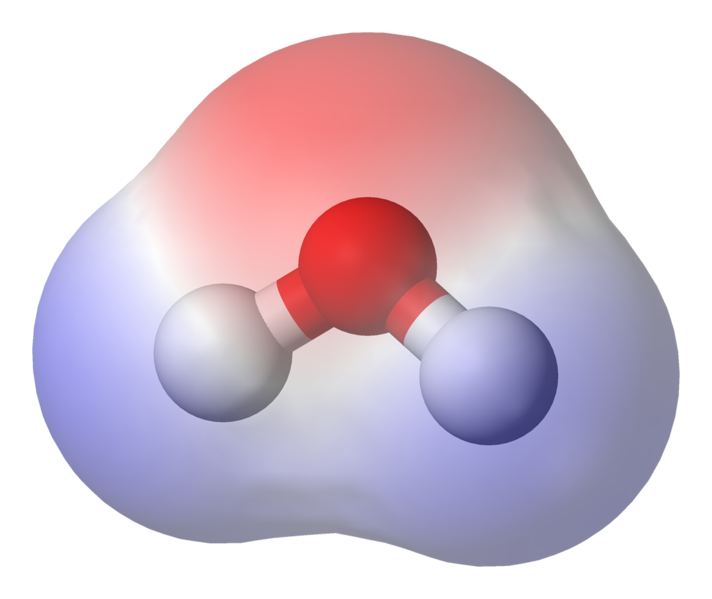
95,84pm mostra la lunghezza del legame tra l’ossigeno e l’idrogeno; one pm è l’abbreviazione di un picometro, che è un trilionesimo di metro. L’angolo mostrato è l’angolo acuto tra i due nuclei di idrogeno (hai qualche idea sul perché non sia “t $ 180 ^ \ circ $? Perché dovrebbe essere $ 180 ^ \ circ $?) Questo diagramma rappresenta i legami come linee, che fa sembrare che siano uguali in ogni punto? Non è così. Poiché l’ossigeno è più elettronegativo dell’idrogeno, attrae gli elettroni nel legame OH verso se stesso. Se lo spessore della linea rappresenta la densità elettronica (la quantità di tempo in cui gli elettroni spendere in quella parte del legame), il legame OH in realtà è più simile a questo:
IMMAGINE che mostra la polarizzazione del legame
Come puoi vedere gli elettroni trascorrono la maggior parte del loro tempo più vicino al nucleo di ossigeno. l’ossigeno è leggermente caricato negativamente e che gli idrogeni sono leggermente caricati positivamente. Questa è chiamata polarità ed è il concetto chiave alla base delle proprietà dell’acqua
Ciò significa che possono verificarsi deboli interazioni ioniche tra n molecole d’acqua adiacenti poiché l’idrogeno leggermente positivo di una molecola è attratto dall’ossigeno leggermente negativo di un’altra. Questi sono chiamati legami idrogeno.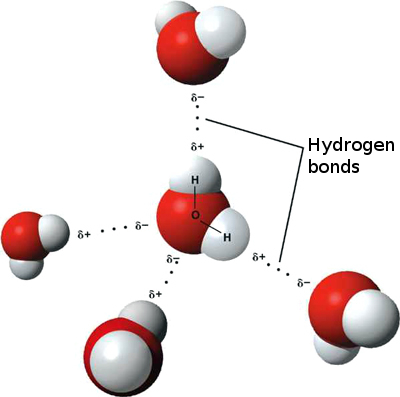
Questo è il motivo per cui l’acqua “si attacca” a se stessa, conferendole un’elevata tensione superficiale e la capacità di muoversi per azione capillare.
È necessaria una grande quantità di energia per abbattere i legami idrogeno, motivo per cui i punti di fusione e di ebollizione dell’acqua sono elevati e perché ha un’elevata capacità termica specifica
Una sostanza si dissolverà in acqua se è polare o ionico. Questo perché si dissolve formando legami idrogeno con l’acqua. Il petrolio non è polare, motivo per cui non si dissolverà. Il sale, NaCl, si dissolve perché è ionico. Riesci a pensare ad altre sostanze solubili in acqua? Come formano legami idrogeno con esso? Puoi disegnare un’immagine simile a quella qui sotto che mostra perché il glucosio è solubile? È più o meno solubile in acqua rispetto al sale? Perché pensi che sia?
Un diagramma di ciò che accade a NaCl in soluzione:
