Voici mes notes de la conférence 15 du cours de chimie 20 de Harvard: chimie organique, donnée par le Dr Ryan Spoering le 6 mars 2015.
Rotation optique
Le fait que les énantiomères tournent différemment la lumière polarisée est une propriété utile pour déterminer la composition d’un mélange, qui peut être quelque part entre racémique (50/50) et pur (tous un énantiomère).
Pour les molécules chirales, vous pouvez rechercher une valeur appelée 20D. 20D signifie la rotation à 20 ° C, avec une longueur de trajet de 1 dm, sous une lumière de sodium où λ = 581 nm (la ligne D du sodium, d’où la D). Cette quantité, associée aux paramètres c = concentration en g / mL et l = longueur du trajet, vous permet de dériver la rotation réelle α, en vertu de l’équation 20D = α / (cl).
| ratio | α | ee |
|---|---|---|
| 100: 0 | +12 | 100% |
| 90:10 | +9,6 | 80% |
| 50:50 | 0 | 0% |
Notez que dans un mélange 90:10, le 10 annule 10 sur 90, donc vous vous retrouvez avec seulement 80% de la rotation que vous auriez dans le mélange 100: 0, pour un 80 % ee.
Pasteur et acide tartrique
En 1848, Pasteur étudiait deux substances apparemment apparentées, l’acide tartrique et l’acide racémique. L’acide tartrique est une substance naturelle qui cristallise parfois dans le vin, et il est dextrorotarien. L’acide racémique était un sous-produit industriel qui semblait identique à l’acide tartrique à tous égards, sauf qu’il n’avait pas de rotation optique. Pasteur était un vitaliste et était très intéressé à élucider la base physique de ce qui distinguait la vie de la non-vie. Il soupçonnait que la rotation optique était spécifique à la force vitale, car de nombreux produits naturels étaient optiquement actifs, alors que les produits synthétiques ne l’étaient presque jamais.
Pasteur a synthétisé l’acide racémique sodium-ammonium et l’a ensuite cristallisé. Il formait un tas de deux types différents de cristaux, qui étaient macroscopiquement distincts. Avec une pince à épiler et un microscope primitif de 1848, vous pouviez en fait séparer la pile en deux piles distinctes de cristaux, qui étaient des images miroir macroscopiques l’une de l’autre. Si vous dissolvez ensuite les deux piles, chacune serait optiquement active, mais dans des directions opposées.
Nous savons maintenant que très peu de mélanges racémiques se comportent de cette façon. La grande majorité formera un cristal racémique; seule une poignée forme des cristaux séparés. De plus, même en sachant cela, il est en fait assez difficile de reproduire l’expérience de Pasteur.
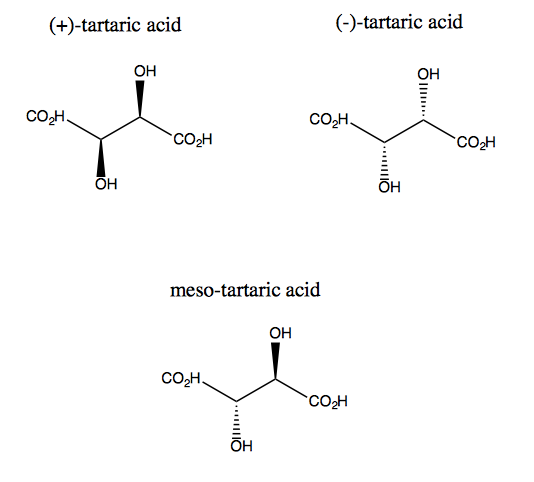
L’acide tartrique et son énantiomère manquent de symétrie plane, bien qu’ils aient chacun une symétrie de rotation double. Il n’existe aucun plan sur lequel vous pouvez réfléchir l’acide tartrique et le superposer encore. Ainsi, la molécule est chirale. Cependant, si vous imaginez que l’axe z dépasse de l’écran, vous pouvez faire pivoter la molécule de 180 ° autour de cet axe, puis la superposer. C’est ce qu’on appelle la symétrie C2. L’acide tartrique a également un diastéréoisomère appelé acide méso-tartrique. Cette molécule a un plan de symétrie, et est donc achirale. En général, tout composé comme celui-ci, ayant des carbones stéréogènes mais aussi un plan de symétrie, est appelé un composé méso.
Stéréospécificité en synthèse
Il existe trois stratégies majeures pour préparer un seul énantiomère. Aujourd’hui, nous allons discuter d’un exemple célèbre qui touche à deux de ces trois méthodes:
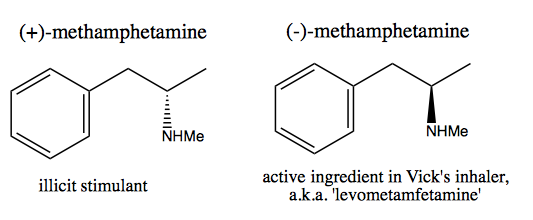
Les gens, comme Walter White , qui souhaitent synthétiser de la dextrométhamphétamine pure pour la vente commerciale, ont développé deux méthodes: pool chiral et résolution.
Pool chiral
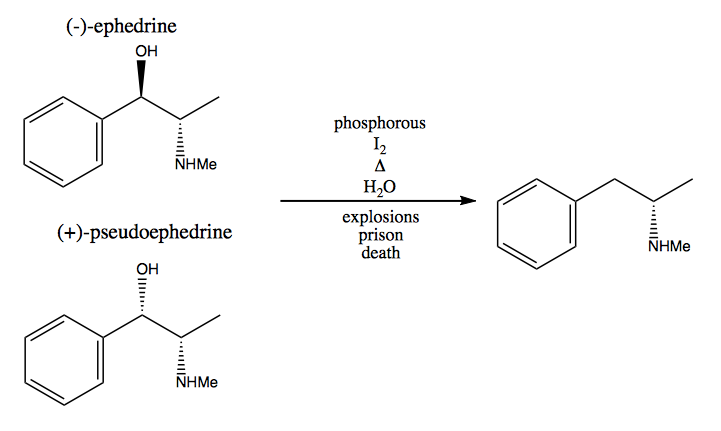
Dans la méthode du pool chiral, vous volez des centres stéréogéniques à la nature. La nature nous fournit un énorme pool de molécules chirales que nous pouvons utiliser comme matières premières. Dans le cas de la dextrométhamphétamine, vous pouvez partir de (-) – éphédrine ou (+) – pseudoéphédrine et supprimer le groupe hydroxyle via une réaction très dangereuse:
Résolution
Comme les efforts de lutte contre la drogue ont rendu de plus en plus difficile l’acquisition de grandes quantités de pseudoéphédrine, les gens se sont de plus en plus tournés vers la méthode de résolution. Dans cette méthode, vous synthétisez d’abord un mélange racémique:
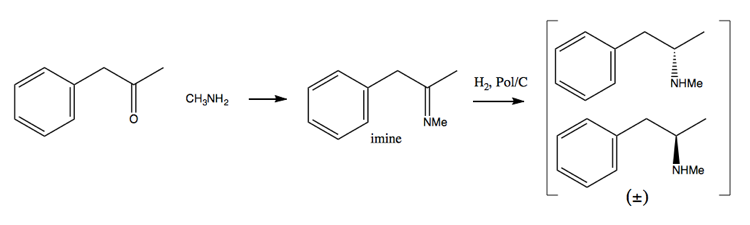
Ensuite, vous le séparez en ajoutant une molécule énantiopure telle que (+ )-l’acide tartrique. (+) – l’acide tartrique formera des sels avec chaque énantiomère, mais les deux sels ont des propriétés physiques différentes, donc dans des conditions prudentes, vous ne pourrez cristalliser que la dextrométhamphétamine.
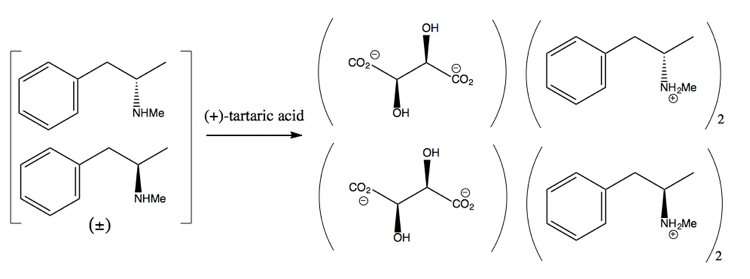
C’est un gaspillage, cependant, car au mieux vous obtenez un rendement de 50%, et en pratique, il est même difficile d’en obtenir autant.
Chiralité sans carbone stéréogène
La prochaine fois, nous parlerons de molécules qui ont une chiralité sans carbone stéréogène. Celles-ci ne sont généralement pas stables et se convertissent assez rapidement. Voici un exemple avec un azote stéréogène:
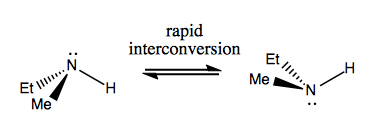
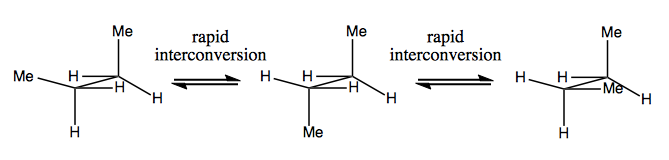
Il y a aussi des exemples étranges où une molécule n’a pas encore de centre stéréogène unique parvient à être globalement chiral. Par exemple, le butane Gauche a une chiralité axiale même si aucun carbone n’est stéréogène. Il s’interconvertit également rapidement: