Estas são minhas notas da aula 15 do curso de Química 20: Química Orgânica de Harvard, ministrado pelo Dr. Ryan Spoering em 6 de março de 2015.
Rotação óptica
O fato de os enantiômeros girarem diferencialmente luz polarizada é uma propriedade útil para determinar a composição de uma mistura, que pode estar em algum lugar entre racêmico (50/50) e puro (todos um enantiômero).
Para moléculas quirais, você pode procurar um valor chamado 20D. 20D significa a rotação a 20 ° C, com um comprimento de caminho de 1 dm, sob uma luz de sódio onde λ = 581 nm (a linha D do sódio, portanto, a D). Esta quantidade, junto com os parâmetros c = concentração em g / mL e l = comprimento do caminho, permite que você derive a rotação real α, em virtude da equação 20D = α / (cl).
| ratio | α | ee |
|---|---|---|
| 100: 0 | +12 | 100% |
| 90:10 | +9,6 | 80% |
| 50:50 | 0 | 0% |
Observe que em uma mistura de 90:10, o 10 cancela 10 de 90, então você acaba com apenas 80% da rotação que teria na mistura de 100: 0, para um 80 % ee.
Pasteur e ácido tartárico
Em 1848, Pasteur estava estudando duas substâncias aparentemente relacionadas, o ácido tartárico e o ácido racêmico. O ácido tartárico é uma substância natural que às vezes se cristaliza no vinho e é dextrógiro. O ácido racêmico era um subproduto industrial que parecia idêntico ao ácido tartárico em todos os aspectos, exceto que não tinha rotação óptica. Pasteur era um vitalista e estava muito interessado em elucidar a base física do que distinguia a vida da não-vida. Ele suspeitou que a rotação óptica era específica para a força vital, porque muitos produtos naturais eram opticamente ativos, enquanto os produtos sintéticos quase nunca o eram.
Pasteur sintetizou ácido racêmico de amônio e sódio e depois o cristalizou. Ele formava uma pilha de dois tipos diferentes de cristais, macroscopicamente distintos. Com uma pinça e um microscópio primitivo de 1848, você poderia separar a pilha em duas pilhas separadas de cristais, que eram imagens macroscópicas no espelho uma da outra. Se você então dissolver novamente as duas pilhas, cada uma ficará opticamente ativa, mas em direções opostas.
Agora sabemos que muito poucas misturas racêmicas se comportam dessa maneira. A grande maioria formará um cristal racêmico; apenas um punhado de cristais separados. Além disso, mesmo sabendo disso, é realmente muito difícil reproduzir o experimento de Pasteur.
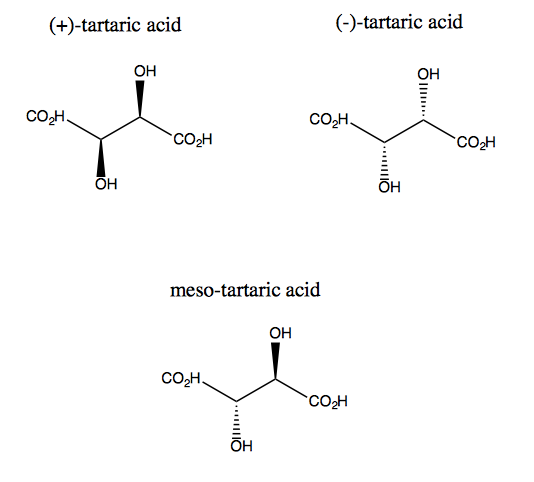
O ácido tartárico e seu enantiômero não têm simetria plana, embora cada um tenha uma simetria rotacional dupla. Não existe um plano através do qual você possa refletir o ácido tartárico e ainda sobrepô-lo. Assim, a molécula é quiral. No entanto, se você imaginar o eixo z saindo da tela, poderá girar a molécula 180 ° em torno desse eixo e sobrepô-la. Isso é chamado de simetria C2. O ácido tartárico também tem um diastereômero chamado ácido meso-tartárico. Essa molécula tem um plano de simetria e, portanto, é aquiral. Em geral, qualquer composto como este, tendo carbonos estereogênicos, mas também um plano de simetria, é chamado de composto meso.
Estereoespecificidade na síntese
Existem três estratégias principais para preparar um único enantiômero. Hoje vamos discutir um exemplo famoso que toca em dois desses três métodos:
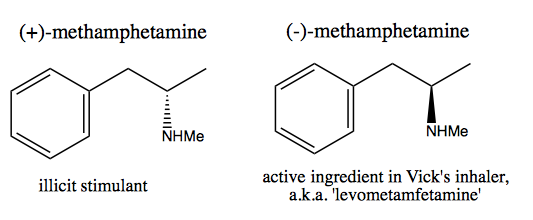
O pessoal, como Walter White , que desejam sintetizar dextrometanfetamina pura para venda comercial, desenvolveram dois métodos: pool quiral e resolução.
Pool quiral
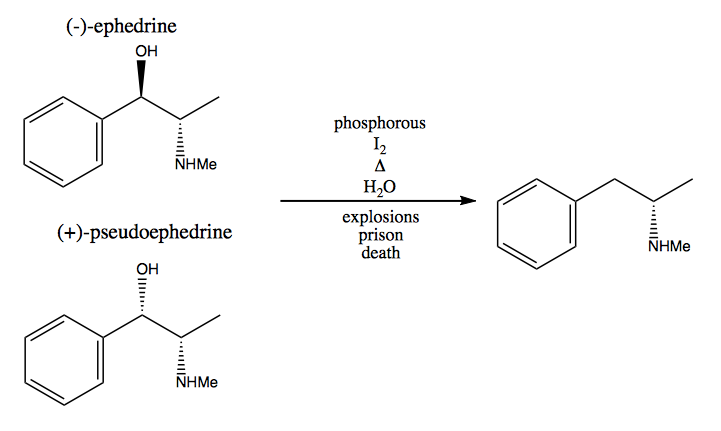
No método do pool quiral, você rouba centros estereogênicos da natureza. A natureza nos fornece um grande conjunto de moléculas quirais que podemos usar como materiais de partida. No caso da dextrometanfetamina, você pode começar com (-) – efedrina ou (+) – pseudoefedrina e remover o grupo hidroxila por meio de uma reação muito perigosa:
Resolução
Como os esforços de repressão às drogas tornaram cada vez mais difícil adquirir grandes quantidades de pseudoefedrina, as pessoas se voltaram mais para o método de resolução. Neste método, você primeiro sintetiza uma mistura racêmica:
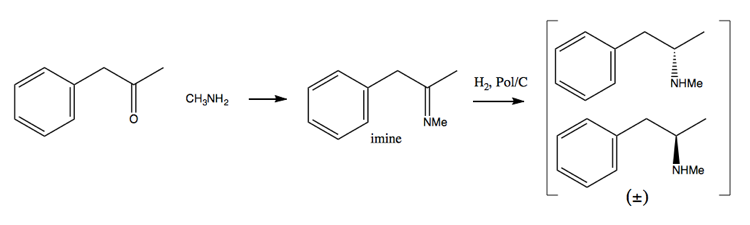
Em seguida, você a separa adicionando uma molécula enantiopura como (+ )-ácido tartárico. (+) – o ácido tartárico formará sais com cada enantiômero, mas os dois sais têm propriedades físicas diferentes, portanto, sob condições cuidadosas, você pode fazer com que apenas a dextrometanfetamina cristalize.
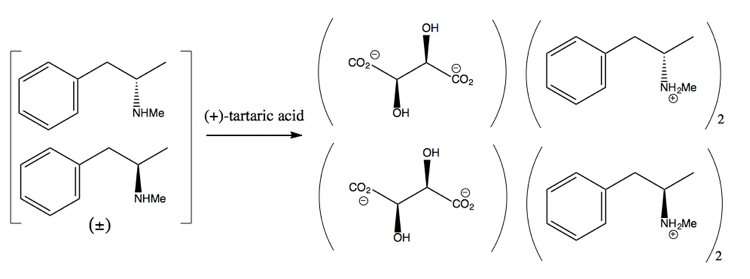
No entanto, isso é um desperdício, pois, na melhor das hipóteses, você obtém 50% de rendimento e, na prática, é difícil conseguir até isso.
Quiralidade sem carbono estereogênico
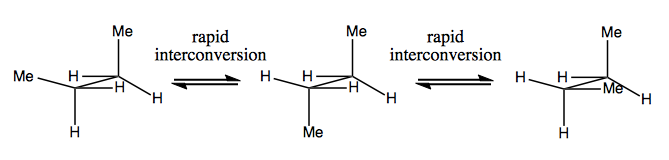
Na próxima vez, discutiremos as moléculas que têm quiralidade sem carbono estereogênico. Eles geralmente não são estáveis e se convertem rapidamente. Aqui está um exemplo com um nitrogênio estereogênico:
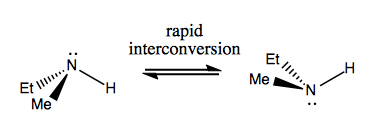
Existem também exemplos estranhos em que uma molécula ainda não tem um centro estereogênico consegue ser quiral em geral. Por exemplo, o butano Gauche tem quiralidade axial, embora nenhum carbono seja estereogênico. Ele também é convertido rapidamente: