Toto jsou mé poznámky z přednášky 15 kurzu Harvard’s Chemistry 20: Organic Chemistry, předneseného Dr. Ryanem Spoeringem 6. března 2015.
Optická rotace
Skutečnost, že enantiomery odlišně rotují polarizované světlo, je užitečnou vlastností pro stanovení složení směsi, která může být někde mezi racemickým (50/50) a čistým (vše jeden enantiomer).
U chirálních molekul můžete vyhledat hodnotu zvanou 20D. 20D znamená rotaci při 20 ° C s délkou dráhy 1 dm pod sodíkovým světlem, kde λ = 581 nm (linie D sodíku, tedy D). Toto množství spolu s parametry c = koncentrace v g / ml a l = délka dráhy vám umožní odvodit skutečnou rotaci α na základě rovnice 20D = α / (cl).
| poměr | α | ee |
|---|---|---|
| 100: 0 | +12 | 100% |
| 90:10 | +9,6 | 80% |
| 50:50 | 0 | 0% |
Všimněte si, že ve směsi 90:10 10 zruší 10 z 90, takže skončíte s pouze 80% rotace, kterou byste měli ve směsi 100: 0, pro 80 % ee.
Pasteur a kyselina vinná
V roce 1848 studoval Pasteur dvě zjevně příbuzné látky, kyselinu vinnou a kyselinu racemickou. Kyselina vinná je přírodní látka, která někdy krystalizuje z vína a je pravotočivá. Racemická kyselina byla průmyslovým vedlejším produktem, který se ve všech ohledech zdál stejný jako kyselina vinná, kromě toho, že neměl optickou rotaci. Pasteur byl vitalista a velmi se zajímal o objasnění fyzického základu toho, co odlišovalo život od života. Měl podezření, že optická rotace je specifická pro vitální sílu, protože mnoho přírodních produktů bylo opticky aktivních, zatímco syntetické produkty téměř nikdy nebyly.
Pasteur syntetizoval racemickou kyselinu amonnou a poté ji krystalizoval. Vytvořila hromadu dvou různých druhů krystalů, které byly makroskopicky odlišné. S pinzetou a primitivním mikroskopem z roku 1848 jste mohli hromadu rozdělit na dvě samostatné hromádky krystalů, které byly makroskopickými zrcadlovými obrazy jeden druhého. Pokud byste znovu rozpustili dvě hromádky, každá by byla opticky aktivní, ale v opačných směrech.
Nyní víme, že se tak chová jen velmi málo racemických směsí. Drtivá většina vytvoří racemický krystal; jen hrstka tvoří samostatné krystaly. Navíc, i když to víme, je vlastně docela obtížné reprodukovat Pasteurův experiment.
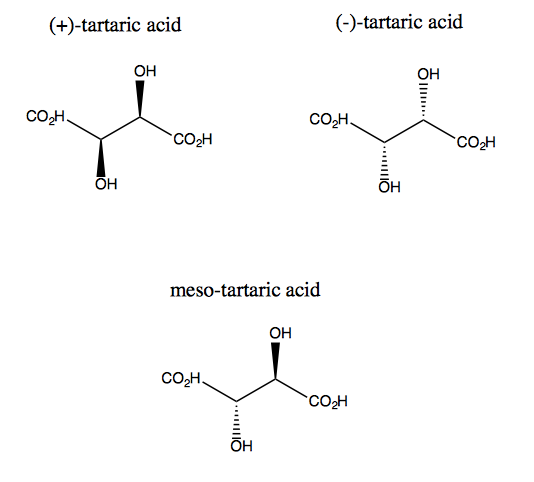
Kyselina vinná a její enantiomer postrádají rovinnou symetrii, i když každá z nich má dvojí rotační symetrii. Neexistuje žádná rovina, přes kterou byste mohli odrážet kyselinu vinnou a stále ji překrývat. Molekula je tedy chirální. Pokud si však představíte, že osa z trčí z obrazovky, můžete molekulu otočit o 180 ° kolem této osy a poté ji překrýt. Tomu se říká symetrie C2. Kyselina vinná má také diastereomer nazývaný kyselina mezovinná. Tato molekula má rovinu symetrie, a je tedy achirální. Obecně se každé takové sloučenině, která má stereogenní uhlíky, ale také rovinu symetrie, říká mezosloučenina.
Stereospecificita v syntéze
Existují tři hlavní strategie pro přípravu jednoho enantiomeru. Dnes probereme slavný příklad, který se dotýká dvou z těchto tří metod:
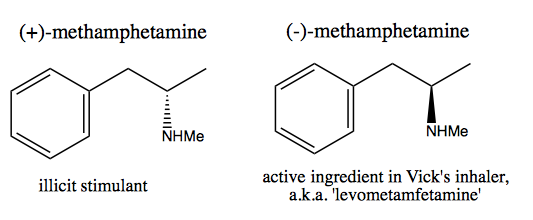
Lidé, jako je Walter White , kteří chtějí syntetizovat čistý dextrometamfetamin pro komerční prodej, vyvinuli dvě metody: chirální fond a řešení.
Chirální fond
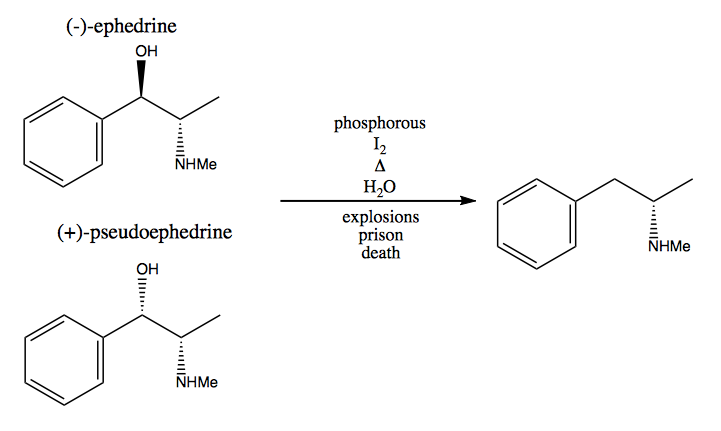
V metodě chirálního fondu ukradnete stereogenní centra z přírody. Příroda nám poskytuje obrovské množství chirálních molekul, které můžeme použít jako výchozí materiály. V případě dextromethamfetaminu můžete začít s (-) – efedrinem nebo (+) – pseudoefedrinem a hydroxylovou skupinu odstranit velmi nebezpečnou reakcí:
Řešení
Vzhledem k tomu, že snahy o vymáhání drog stále více ztěžovaly získávání velkého množství pseudoefedrinu, lidé se více zaměřili na metodu řešení. V této metodě nejprve syntetizujete racemickou směs:
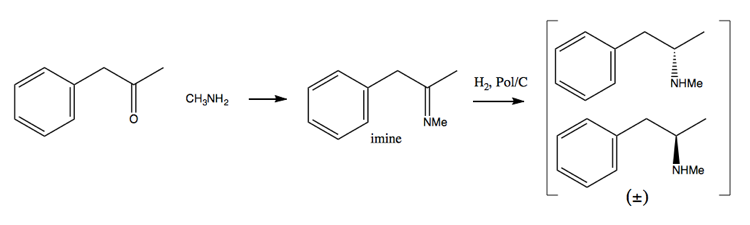
Poté ji oddělíte přidáním enantiočisté molekuly, jako je (+ )-kyselina vinná. Kyselina (+) – vinná bude tvořit soli s každým enantiomerem, ale obě soli mají různé fyzikální vlastnosti, takže za pečlivých podmínek můžete vykrystalovat pouze dextromethamfetamin.
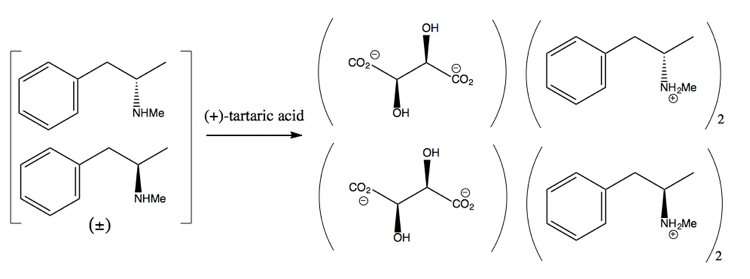
To je však plýtvání, protože v nejlepším případě získáte 50% výtěžek a v praxi je těžké sehnat ani tolik.
Chiralita bez stereogenního uhlíku
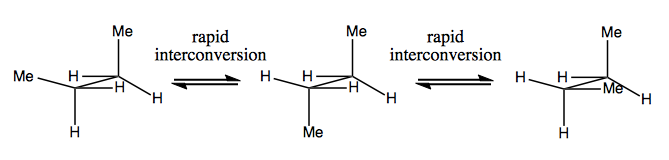
Příště si povíme molekuly, které mají chiralitu bez stereogenního uhlíku. Obvykle nejsou stabilní a interkonvertují poměrně rychle. Zde je příklad se stereogenním dusíkem:
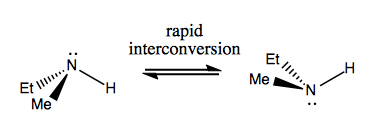
Existují také podivné příklady, kdy molekula dosud nemá jediné stereogenní centrum dokáže být celkově chirální. Například Gauche butan má axiální chiralitu, i když žádný uhlík není stereogenní. Také se rychle převádí: