Dies sind meine Notizen aus Vorlesung 15 von Harvards Kurs Chemie 20: Organische Chemie, gehalten von Dr. Ryan Spoering am 6. März 2015.
Optische Drehung
Die Tatsache, dass Enantiomere polarisiertes Licht unterschiedlich drehen, ist eine nützliche Eigenschaft zur Bestimmung der Zusammensetzung eines Gemisches, das irgendwo zwischen racemisch (50/50) und rein (alle) liegen kann ein Enantiomer).
Für chirale Moleküle können Sie einen Wert namens 20D nachschlagen. 20D bedeutet die Drehung bei 20 ° C mit einer Weglänge von 1 dm unter einem Natriumlicht mit λ = 581 nm (die Natrium-D-Linie, daher das D). Diese Größe ermöglicht es Ihnen zusammen mit den Parametern c = Konzentration in g / ml und l = Weglänge, die tatsächliche Drehung α gemäß der Gleichung 20D = α / (cl) abzuleiten.
| ratio | α | ee |
|---|---|---|
| 100: 0 | +12 | 100% |
| 90:10 | +9,6 | 80% |
| 50:50 | 0 | 0% |
Beachten Sie, dass in einer 90: 10-Mischung die 10 10 von den 90 annullieren, sodass Sie nur 80% der Rotation erhalten, die Sie in der 100: 0-Mischung für eine 80 haben würden % ee.
Pasteur und Weinsäure
1848 untersuchte Pasteur zwei anscheinend verwandte Substanzen, Weinsäure und Raceminsäure. Weinsäure ist eine natürliche Substanz, die manchmal aus Wein kristallisiert und rechtsdrehend ist. Raceminsäure war ein industrielles Nebenprodukt, das in jeder Hinsicht mit Weinsäure identisch zu sein schien, außer dass es keine optische Rotation aufwies. Pasteur war ein Vitalist und war sehr daran interessiert, die physischen Grundlagen dessen aufzuklären, was das Leben vom Nichtleben unterscheidet. Er vermutete, dass die optische Rotation spezifisch für die Vitalkraft war, da viele Naturstoffe optisch aktiv waren, während synthetische Produkte dies fast nie waren. Pasteur synthetisierte Natriumammonium-Raceminsäure und kristallisierte sie dann aus. Es bildete einen Haufen von zwei verschiedenen Arten von Kristallen, die makroskopisch verschieden waren. Mit einer Pinzette und einem primitiven Mikroskop von 1848 konnte man den Stapel tatsächlich in zwei separate Kristallstapel zerlegen, die makroskopische Spiegelbilder voneinander waren. Wenn Sie dann die beiden Stapel wieder auflösen würden, wäre jeder optisch aktiv, jedoch in entgegengesetzten Richtungen.
Wir wissen jetzt, dass sich nur sehr wenige racemische Gemische so verhalten. Die überwiegende Mehrheit wird einen racemischen Kristall bilden; nur eine Handvoll bilden separate Kristalle. Selbst wenn man das weiß, ist es tatsächlich ziemlich schwierig, Pasteurs Experiment zu reproduzieren.
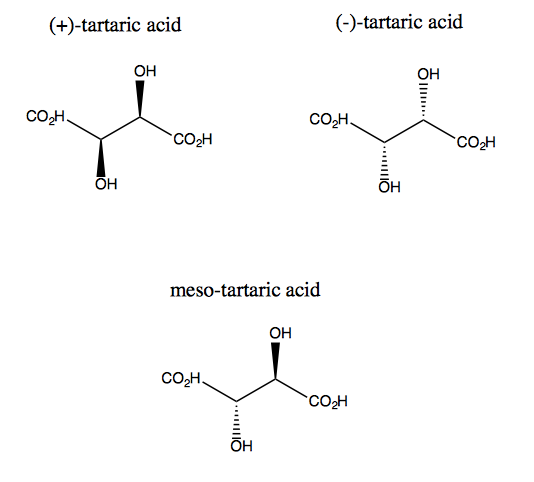
Weinsäure und ihr Enantiomer weisen keine ebene Symmetrie auf, obwohl sie jeweils eine zweifache Rotationssymmetrie aufweisen. Es gibt keine Ebene, über die Sie Weinsäure reflektieren und dennoch überlagern können. Somit ist das Molekül chiral. Wenn Sie sich jedoch vorstellen, dass die z-Achse aus dem Bildschirm herausragt, können Sie das Molekül um 180 ° um diese Achse drehen und dann überlagern. Dies wird als C2-Symmetrie bezeichnet. Weinsäure hat auch ein Diastereomer namens Meso-Weinsäure. Dieses Molekül hat eine Symmetrieebene und ist daher achiral. Im Allgemeinen wird jede Verbindung wie diese mit stereogenen Kohlenstoffen, aber auch einer Symmetrieebene als Mesoverbindung bezeichnet.
Stereospezifität in der Synthese
Es gibt drei Hauptstrategien zur Herstellung eines einzelnen Enantiomers. Heute werden wir ein berühmtes Beispiel diskutieren, das zwei dieser drei Methoden berührt:
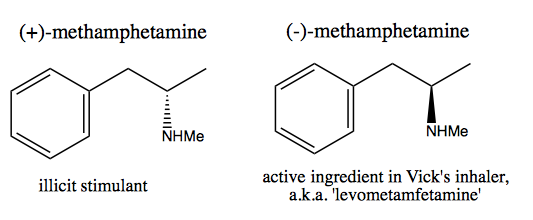
Die Leute wie Walter White , die reines Dextromethamphetamin für den kommerziellen Verkauf synthetisieren möchten, haben zwei Methoden entwickelt: Chiraler Pool und Auflösung.
Chiraler Pool
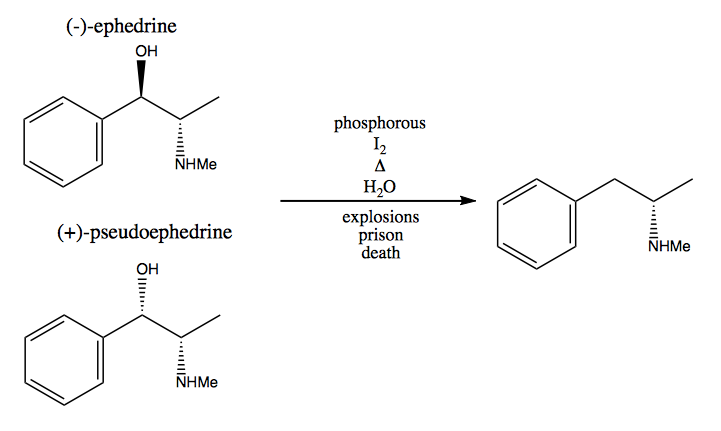
Bei der chiralen Poolmethode stehlen Sie der Natur stereogene Zentren. Die Natur bietet uns einen riesigen Pool an chiralen Molekülen, die wir als Ausgangsmaterialien verwenden können. Im Fall von Dextromethamphetamin können Sie von (-) – Ephedrin oder (+) – Pseudoephedrin ausgehen und die Hydroxylgruppe über eine sehr gefährliche Reaktion entfernen:
Auflösung
Da die Bemühungen zur Durchsetzung von Drogen den Erwerb großer Mengen Pseudoephedrin immer schwieriger gemacht haben, haben sich die Menschen mehr der Auflösungsmethode zugewandt. Bei dieser Methode synthetisieren Sie zuerst eine racemische Mischung:
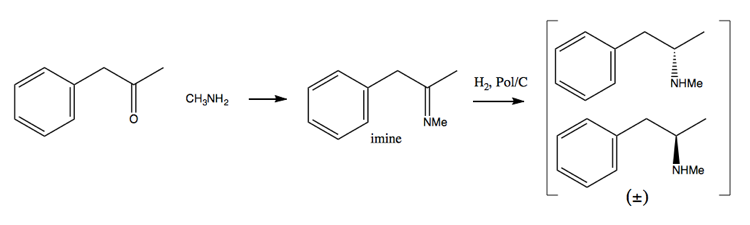
Anschließend trennen Sie sie durch Hinzufügen eines enantiomerenreinen Moleküls wie (+) )-Weinsäure. (+) – Weinsäure bildet mit jedem Enantiomer Salze, aber die beiden Salze haben unterschiedliche physikalische Eigenschaften, so dass unter sorgfältigen Bedingungen nur das Dextromethamphetamin kristallisieren kann.
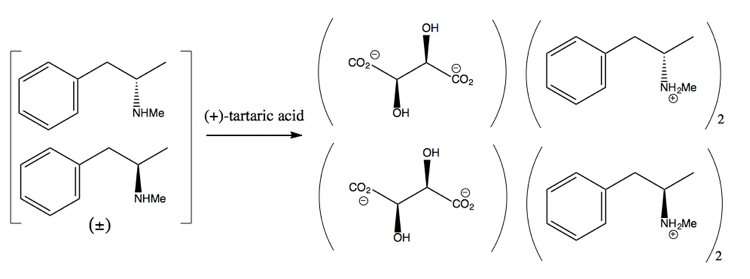
Dies ist jedoch verschwenderisch, da Sie bestenfalls eine Ausbeute von 50% erzielen und es in der Praxis schwierig ist, auch nur so viel zu erzielen.
Chiralität ohne stereogenen Kohlenstoff
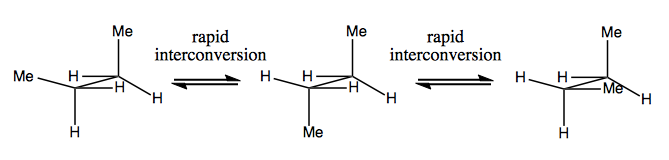
Das nächste Mal werden wir Moleküle diskutieren, die Chiralität ohne stereogenen Kohlenstoff aufweisen. Diese sind normalerweise nicht stabil und wandeln sich ziemlich schnell um. Hier ist ein Beispiel mit einem stereogenen Stickstoff:
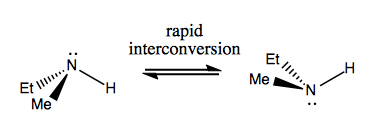
Es gibt auch seltsame Beispiele, bei denen ein Molekül noch kein einziges stereogenes Zentrum hat schafft es, insgesamt chiral zu sein. Zum Beispiel hat Gauche-Butan eine axiale Chiralität, obwohl kein Kohlenstoff stereogen ist. Auch es konvertiert schnell: