Dette er mine notater fra forelesning 15 i Harvards kjemi 20: Organisk kjemi-kurs, levert av Dr. Ryan Spoering 6. mars 2015.
Optisk rotasjon
Det faktum at enantiomerer roterer polarisert lys forskjellig, er en nyttig egenskap for å bestemme sammensetningen av en blanding, som kan være et sted mellom racemisk (50/50) og ren (alle en enantiomer).
For chirale molekyler kan du slå opp en verdi kalt 20D. 20D betyr rotasjonen ved 20 ° C, med en banelengde på 1 dm, under et natriumlys der λ = 581 nm (natrium D-linjen, derav D). Denne mengden, sammen med parametrene c = konsentrasjon i g / ml og l = banelengde, lar deg utlede den faktiske rotasjonen α i kraft av ligningen 20D = α / (cl).
| ratio | α | ee |
|---|---|---|
| 100: 0 | +12 | 100% |
| 90:10 | +9,6 | 80% |
| 50:50 | 0 | 0% |
Vær oppmerksom på at i en 90:10 blanding kansellerer 10 ut 10 av 90, så du ender med bare 80% av rotasjonen du vil ha i 100: 0 blandingen, for en 80 % ee.
Pasteur og vinsyre
I 1848 studerte Pasteur to tilsynelatende relaterte stoffer, vinsyre og raceminsyre. Vinsyre er et naturlig stoff som noen ganger krystalliserer seg ut av vin, og det er dextrorotary. Raceminsyre var et industrielt biprodukt som i alle henseender virket identisk med vinsyre, bortsett fra at den ikke hadde noen optisk rotasjon. Pasteur var en vitalist og var veldig interessert i å belyse det fysiske grunnlaget for det som skilte livet fra ikke-livet. Han mistenkte at optisk rotasjon var spesifikk for vital kraft, fordi mange naturlige produkter var optisk aktive, mens syntetiske produkter nesten aldri var det.
Pasteur syntetiserte raceminsyre av natriumammonium og krystalliserte den deretter. Det dannet en haug med to forskjellige typer krystaller, som var makroskopisk forskjellige. Med en pinsett og et primitivt mikroskop fra 1848 kunne du faktisk plukke bunken fra hverandre i to separate bunker med krystaller, som var makroskopiske speilbilder av hverandre. Hvis du da oppløste de to haugene på nytt, ville hver være optisk aktiv, men i motsatt retning.
Vi vet nå at svært få racemiske blandinger oppfører seg slik. De aller fleste vil danne en rasemisk krystall; bare en håndfull danner separate krystaller. Dessuten, selv om vi vet dette, er det faktisk ganske vanskelig å gjengi Pasteurs eksperiment.
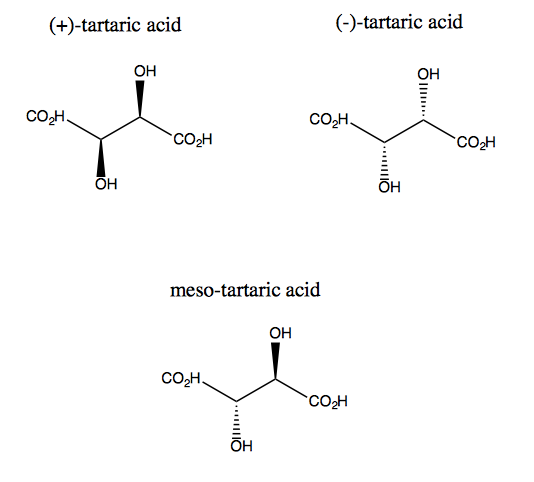
Vinsyre og dens enantiomer mangler plansymmetri, selv om de begge har to ganger rotasjonssymmetri. Det eksisterer ingen plan som du kan reflektere vinsyre og fortsatt legge den over. Dermed er molekylet kiralt. Imidlertid, hvis du forestiller deg at z-aksen stikker ut av skjermen, kan du rotere molekylet 180 ° rundt den aksen, og deretter legge det over. Dette kalles C2 symmetri. Vinsyre har også en diastereomer kalt meso-vinsyre. Dette molekylet har et symmetriplan og er derfor achiralt. Generelt kalles enhver forbindelse som denne, som har stereogene karbonatomer, men også et symmetriplan, en mesoforbindelse.
Stereospesifisitet i syntese
Det er tre hovedstrategier for å forberede en enkelt enantiomer. I dag vil vi diskutere et kjent eksempel som berører to av disse tre metodene:
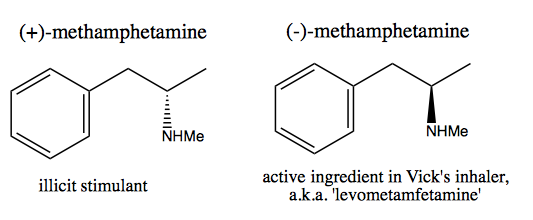
Folk, som Walter White , som ønsker å syntetisere rent dextrometamfetamin for kommersielt salg, har utviklet to metoder: chiral pool og oppløsning.
Chiral pool
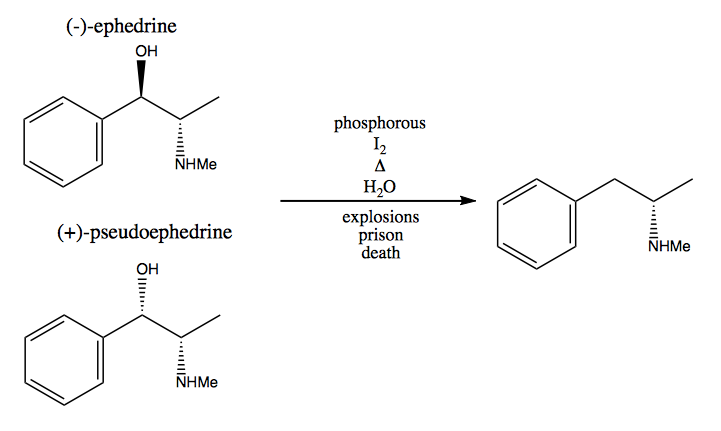
I metoden chiral pool stjeler du stereogene sentre fra naturen. Naturen gir oss et stort basseng av chirale molekyler som vi kan bruke som utgangsmaterialer. Når det gjelder dekstrometamfetamin, kan du starte fra (-) – efedrin eller (+) – pseudoefedrin og fjerne hydroksylgruppen via en veldig farlig reaksjon:
Løsning
Ettersom narkotikahåndteringsarbeidet har gjort det vanskeligere og vanskeligere å skaffe store mengder pseudoefedrin, har folk vendt seg mer mot oppløsningsmetoden. I denne metoden syntetiserer du først en racemisk blanding:
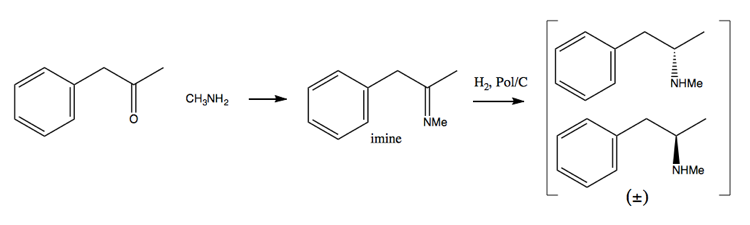
Deretter skiller du den ved å legge til en enantiopure molekyl som (+ )-vinsyre. (+) – vinsyre vil danne salter med hver enantiomer, men de to saltene har forskjellige fysiske egenskaper, så under nøye forhold kan du bare få dekstrometamfetamin til å krystallisere seg.
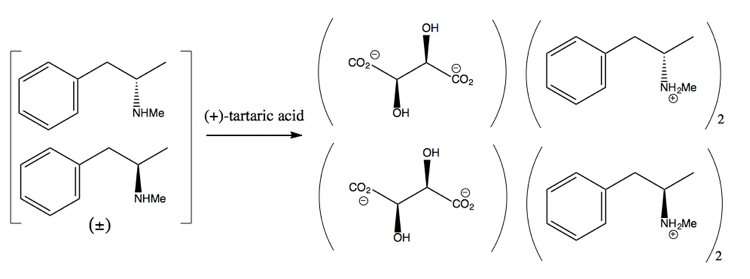
Dette er imidlertid bortkastet, siden du i beste fall får 50% avkastning, og i praksis er det vanskelig å få til og med så mye.
Chiralitet uten stereogent karbon
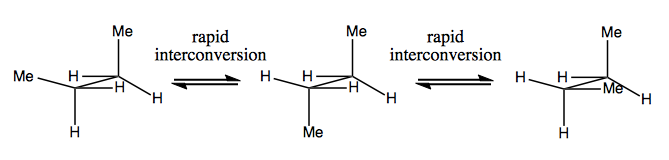
Neste gang skal vi diskutere molekyler som har chiralitet uten stereogent karbon. Disse er vanligvis ikke stabile, og konverterer ganske raskt. Her er et eksempel med et stereogent nitrogen:
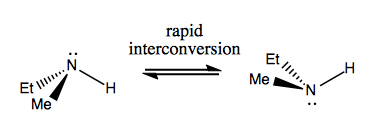
Det er også rare eksempler der et molekyl ikke har noe enkelt stereogent senter, ennå klarer å være chiral generelt. For eksempel har Gauche butan aksial chiralitet selv om ingen karbon er stereogen. Også den konverterer raskt: