Questi sono i miei appunti dalla lezione 15 del corso di Chimica 20 di Harvard: Chimica organica, tenuto dal Dr. Ryan Spoering il 6 marzo 2015.
Rotazione ottica
Il fatto che gli enantiomeri ruotino in modo differenziale la luce polarizzata è una proprietà utile per determinare la composizione di una miscela, che può essere da qualche parte tra racemica (50/50) e pura (tutto un enantiomero).
Per le molecole chirali, è possibile cercare un valore chiamato 20D. 20D indica la rotazione a 20 ° C, con un percorso di 1 dm, sotto una luce al sodio dove λ = 581 nm (la linea D del sodio, da cui la D). Questa quantità, insieme ai parametri c = concentrazione in g / mL el = lunghezza del percorso, permette di ricavare la rotazione effettiva α, in virtù dell’equazione 20D = α / (cl).
| ratio | α | ee |
|---|---|---|
| 100: 0 | +12 | 100% |
| 90:10 | +9,6 | 80% |
| 50:50 | 0 | 0% |
Nota che in una miscela 90:10, il 10 cancella 10 su 90, quindi finisci con solo l’80% della rotazione che avresti nella miscela 100: 0, per un 80 % ee.
Pasteur e acido tartarico
Nel 1848 Pasteur stava studiando due sostanze apparentemente correlate, l’acido tartarico e l’acido racemico. L’acido tartarico è una sostanza naturale che a volte si cristallizza dal vino ed è destrogiro. L’acido racemico era un sottoprodotto industriale che sembrava identico all’acido tartarico sotto tutti gli aspetti, tranne per il fatto che non aveva rotazione ottica. Pasteur era un vitalista ed era molto interessato a chiarire le basi fisiche di ciò che distingueva la vita dalla non vita. Sospettava che la rotazione ottica fosse specifica della forza vitale, perché molti prodotti naturali erano otticamente attivi, mentre i prodotti sintetici non lo erano quasi mai.
Pasteur sintetizzava acido racemico sodio ammonio e poi lo cristallizzava. Forma una pila di due diversi tipi di cristalli, macroscopicamente distinti. Con un paio di pinzette e un microscopio primitivo del 1848, potresti effettivamente separare la pila in due pile separate di cristalli, che erano immagini speculari macroscopiche l’una dell’altra. Se poi sciogliessi nuovamente le due pile, ciascuna sarebbe otticamente attiva, ma in direzioni opposte.
Ora sappiamo che pochissime miscele racemiche si comportano in questo modo. La stragrande maggioranza formerà un cristallo racemico; solo una manciata forma cristalli separati. Inoltre, anche sapendo questo, è in realtà abbastanza difficile riprodurre l’esperimento di Pasteur.
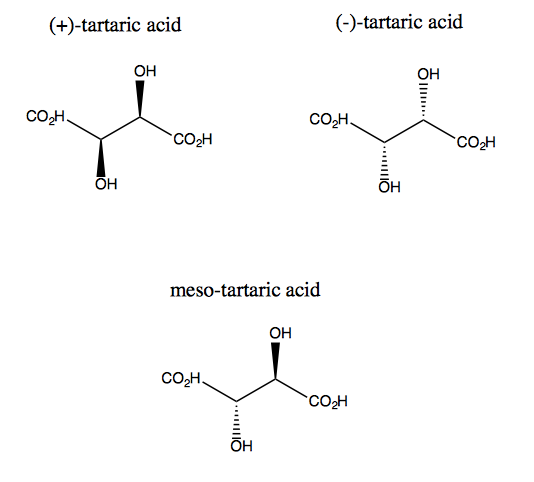
L’acido tartarico e il suo enantiomero mancano di simmetria piana, sebbene ciascuno di essi abbia una simmetria rotazionale duplice. Non esiste alcun piano attraverso il quale è possibile riflettere l’acido tartarico e ancora sovrapporlo. Quindi la molecola è chirale. Tuttavia, se immagini che l’asse z sporga dallo schermo, puoi ruotare la molecola di 180 ° attorno a quell’asse e quindi sovrapporla. Questa è chiamata simmetria C2. L’acido tartarico ha anche un diastereomero chiamato acido meso-tartarico. Questa molecola ha un piano di simmetria ed è quindi achirale. In generale, qualsiasi composto come questo, che abbia atomi di carbonio stereogenici ma anche un piano di simmetria, è chiamato composto meso.
Stereospecificità in sintesi
Esistono tre strategie principali per preparare un singolo enantiomero. Oggi discuteremo un famoso esempio che tocca due di questi tre metodi:
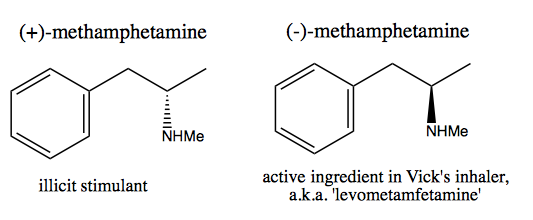
La gente, come Walter White , che desiderano sintetizzare la destrometamfetamina pura per la vendita commerciale, hanno sviluppato due metodi: pool chirale e risoluzione.
pool chirale
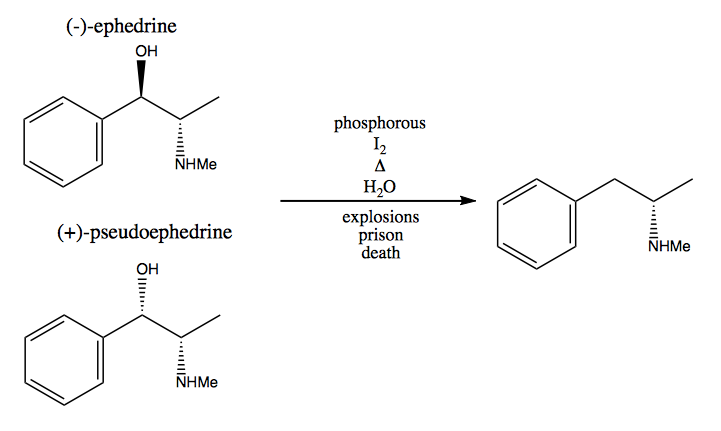
Nel metodo del pool chirale, rubi i centri stereogenici dalla natura. La natura ci fornisce un enorme pool di molecole chirali che possiamo utilizzare come materiali di partenza. Nel caso della destrometamfetamina, puoi iniziare da (-) – efedrina o (+) – pseudoefedrina e rimuovere il gruppo idrossile tramite una reazione molto pericolosa:
Risoluzione
Poiché gli sforzi di contrasto alla droga hanno reso sempre più difficile acquisire grandi quantità di pseudoefedrina, le persone si sono rivolte maggiormente al metodo di risoluzione. In questo metodo, prima sintetizzi una miscela racemica:
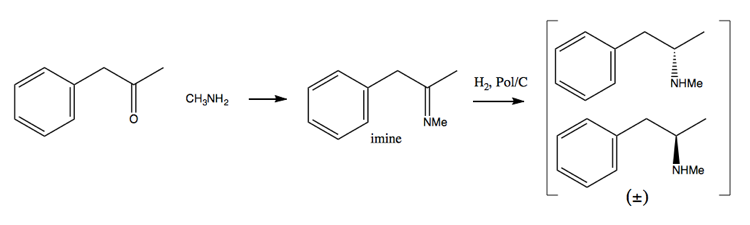
Quindi la separa aggiungendo una molecola enantiopura come (+ )-acido tartarico. (+) – L’acido tartarico formerà sali con ciascun enantiomero, ma i due sali hanno proprietà fisiche diverse, quindi in condizioni attente puoi far cristallizzare solo la destrometamfetamina.
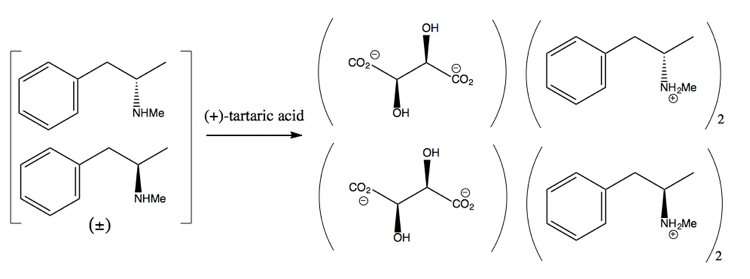
Questo è uno spreco, tuttavia, poiché nella migliore delle ipotesi ottieni il 50% di rendimento, e in pratica è difficile ottenere anche così tanto.
Chiralità senza carbonio stereogenico
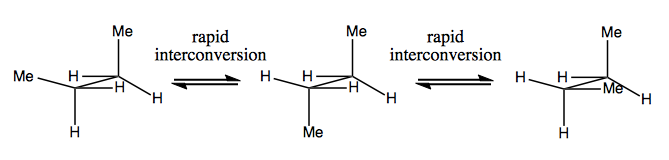
La prossima volta parleremo di molecole che hanno chiralità senza carbonio stereogenico. Di solito non sono stabili e si interconvertono abbastanza rapidamente. Ecco un esempio con un azoto stereogenico:
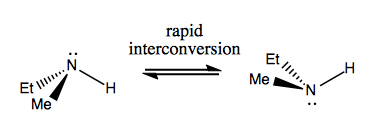
Ci sono anche strani esempi in cui una molecola non ha ancora un singolo centro stereogenico riesce ad essere chirale nel complesso. Ad esempio, il butano Gauche ha una chiralità assiale anche se nessun carbonio è stereogenico. Anch’esso si converte rapidamente: