Acestea sunt notele mele din prelegerea 15 a cursului de chimie 20: chimie organică de la Harvard, susținută de dr. Ryan Spoering în 6 martie 2015.
Rotație optică
Faptul că enantiomerii rotesc diferențial lumina polarizată este o proprietate utilă pentru determinarea compoziției unui amestec, care poate fi undeva între racemic (50/50) și pur (toate un enantiomer).
Pentru moleculele chirale, puteți căuta o valoare numită 20D. 20D înseamnă rotația la 20 ° C, cu o lungime a traseului de 1 dm, sub o lumină de sodiu unde λ = 581 nm (linia D de sodiu, deci D). Această cantitate, împreună cu parametrii c = concentrație în g / mL și l = lungimea căii, vă permite să obțineți rotația efectivă α, în virtutea ecuației 20D = α / (cl).
| ratio | α | ee |
|---|---|---|
| 100: 0 | +12 | 100% |
| 90:10 | +9.6 | 80% |
| 50:50 | 0 | 0% |
Rețineți că într-un amestec de 90:10, cele 10 anulează 10 din 90, deci ajungeți la doar 80% din rotația pe care ați avea-o în amestecul 100: 0, pentru un 80 % ee.
Pasteur și acid tartric
În 1848, Pasteur studia două substanțe aparent înrudite, acidul tartric și acidul racemic. Acidul tartric este o substanță naturală care uneori cristalizează din vin și este dextrorotar. Acidul racemic a fost un produs secundar industrial care părea identic cu acidul tartric din toate punctele de vedere, cu excepția faptului că nu avea rotație optică. Pasteur era un vitalist și era foarte interesat să elucideze baza fizică a ceea ce distinge viața de non-viață. El a suspectat că rotația optică este specifică forței vitale, deoarece multe produse naturale erau active din punct de vedere optic, în timp ce produsele sintetice aproape niciodată nu au fost.
Pasteur a sintetizat acid racemic de sodiu amoniu și apoi l-a cristalizat. A format o grămadă de două tipuri diferite de cristale, care au fost macroscopic distincte. Cu o pereche de pensete și un microscop primitiv din 1848, ați putea de fapt să separați grămada în două grămezi separate de cristale, care erau imagini în oglindă macroscopice. Dacă apoi veți re-dizolva cele două grămezi, fiecare ar fi optic activ, dar în direcții opuse.
Acum știm că foarte puține amestecuri racemice se comportă astfel. Marea majoritate va forma un cristal racemic; doar o mână formează cristale separate. Mai mult, chiar știind acest lucru, este de fapt destul de dificil să reproducem experimentul lui Pasteur.
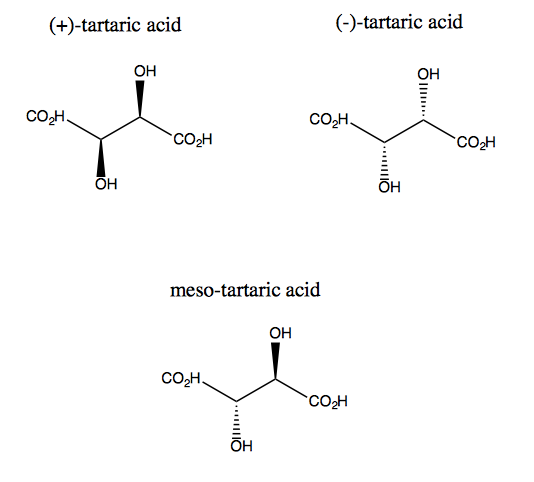
Acidul tartric și enantiomerul său nu au simetrie plană, deși fiecare are simetrie de rotație dublă. Nu există niciun plan peste care să puteți reflecta acidul tartric și să îl suprapuneți. Astfel, molecula este chirală. Cu toate acestea, dacă vă imaginați axa z ieșind din ecran, puteți roti molecula cu 180 ° în jurul acelei axe și apoi să o suprapuneți. Aceasta se numește simetrie C2. Acidul tartric are și un diastereomer numit acid mezo-tartric. Această moleculă are un plan de simetrie și, prin urmare, este achirală. În general, orice compus ca acesta, având carboni stereogeni, dar și un plan de simetrie, este numit compus mezo.
Stereospecificitatea în sinteză
Există trei strategii majore pentru prepararea unui singur enantiomer. Astăzi vom discuta despre un exemplu celebru care atinge două dintre aceste trei metode:
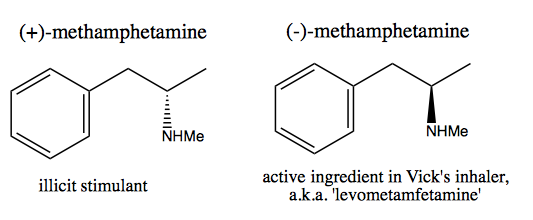
Oamenii, precum Walter White , care doresc să sintetizeze dextrometamfetamina pură pentru vânzare comercială, au dezvoltat două metode: rezerva chirală și rezoluție.
Rezerva chirală
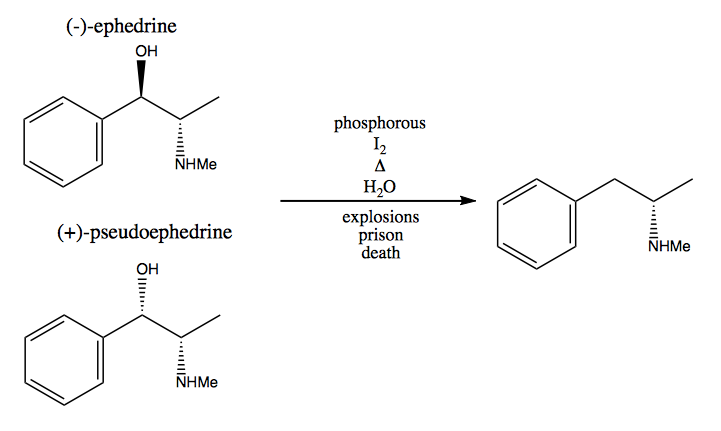
În metoda rezervei chirale, furați centri stereogeni din natură. Natura ne oferă un imens bazin de molecule chirale pe care le putem folosi ca materii prime. În cazul dextrometamfetaminei, puteți începe de la (-) – efedrină sau (+) – pseudoefedrină și a elimina gruparea hidroxil printr-o reacție foarte periculoasă:
Rezoluție
Deoarece eforturile de aplicare a drogurilor au făcut din ce în ce mai dificilă achiziționarea unor cantități mari de pseudoefedrină, oamenii s-au orientat mai mult spre metoda de rezolvare. În această metodă, sintetizați mai întâi un amestec racemic:
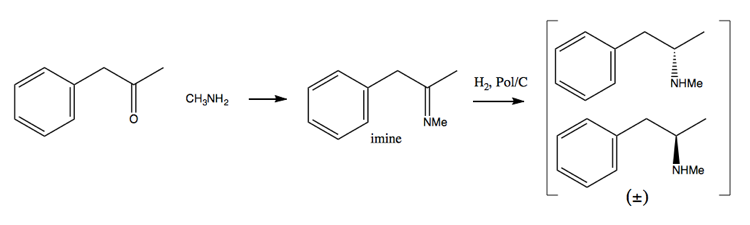
Apoi îl separați adăugând o moleculă enantiopură precum (+ )-acid tartaric. (+) – acidul tartric va forma săruri cu fiecare enantiomer, dar cele două săruri au proprietăți fizice diferite, astfel încât, în condiții atente, puteți obține doar dextrometamfetamina să cristalizeze.
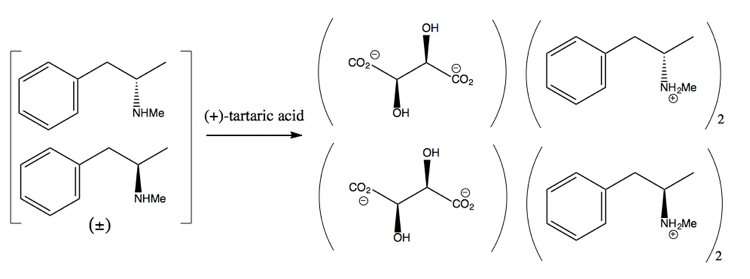
Cu toate acestea, este risipitor, deoarece în cel mai bun caz obțineți un randament de 50% și, în practică, este greu să obțineți chiar atât de mult.
Chiralitatea fără carbon stereogen
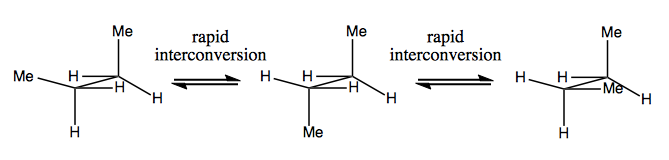
Data viitoare, vom discuta despre moleculele care au chiralitate fără carbon stereogen. Acestea nu sunt, de obicei, stabile și se converg destul de repede. Iată un exemplu cu azot stereogen:
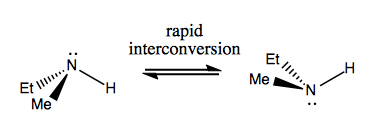
Există, de asemenea, exemple ciudate în care o moleculă nu are încă un singur centru stereogen. reușește să fie chiral în general. De exemplu, butanul Gauche are chiralitate axială, chiar dacă niciun carbon nu este stereogen. De asemenea, se convertește rapid: