Estas son mis notas de la lección 15 del curso de Química 20: Química orgánica de Harvard, impartido por el Dr. Ryan Spoering el 6 de marzo de 2015.
Rotación óptica
El hecho de que los enantiómeros roten diferencialmente la luz polarizada es una propiedad útil para determinar la composición de una mezcla, que puede estar entre racémica (50/50) y pura (todas un enantiómero).
Para moléculas quirales, puede buscar un valor llamado 20D. 20D significa la rotación a 20 ° C, con una longitud de trayectoria de 1 dm, bajo una luz de sodio donde λ = 581 nm (la línea D del sodio, de ahí la D). Esta cantidad, junto con los parámetros c = concentración en g / mL yl = longitud de trayectoria, le permite derivar la rotación real α, en virtud de la ecuación 20D = α / (cl).
| relación | α | ee |
|---|---|---|
| 100: 0 | +12 | 100% |
| 90:10 | +9,6 | 80% |
| 50:50 | 0 | 0% |
Tenga en cuenta que en una mezcla 90:10, el 10 cancela 10 de los 90, por lo que termina con solo el 80% de la rotación que tendría en la mezcla 100: 0, para un 80 % ee.
Pasteur y ácido tartárico
En 1848, Pasteur estaba estudiando dos sustancias aparentemente relacionadas, el ácido tartárico y el ácido racémico. El ácido tartárico es una sustancia natural que a veces cristaliza en el vino y es dextrorrotaria. El ácido racémico era un subproducto industrial que parecía idéntico al ácido tartárico en todos los aspectos, excepto que no tenía rotación óptica. Pasteur era un vitalista y estaba muy interesado en dilucidar la base física de lo que distinguía la vida de la no vida. Sospechaba que la rotación óptica era específica de la fuerza vital, porque muchos productos naturales eran ópticamente activos, mientras que los productos sintéticos casi nunca lo eran.
Pasteur sintetizó ácido racémico de sodio y amonio y luego lo cristalizó. Formó una pila de dos tipos diferentes de cristales, que eran macroscópicamente distintos. Con un par de pinzas y un microscopio primitivo de 1848, se podía separar la pila en dos pilas separadas de cristales, que eran imágenes especulares macroscópicas entre sí. Si luego vuelve a disolver las dos pilas, cada una sería ópticamente activa, pero en direcciones opuestas.
Ahora sabemos que muy pocas mezclas racémicas se comportan de esta manera. La gran mayoría formará un cristal racémico; sólo un puñado forma cristales separados. Además, incluso sabiendo esto, en realidad es bastante difícil reproducir el experimento de Pasteur.
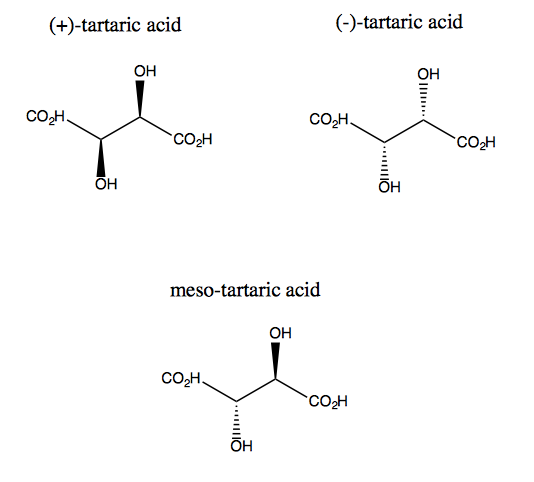
El ácido tartárico y su enantiómero carecen de simetría plana, aunque cada uno tiene simetría rotacional doble. No existe un plano a través del cual pueda reflejar el ácido tartárico y aun así superponerlo. Por tanto, la molécula es quiral. Sin embargo, si imagina que el eje z sobresale de la pantalla, puede girar la molécula 180 ° alrededor de ese eje y luego superponerlo. Esto se llama simetría C2. El ácido tartárico también tiene un diastereómero llamado ácido meso-tartárico. Esta molécula tiene un plano de simetría y, por lo tanto, es aquiral. En general, cualquier compuesto como este, que tenga carbonos estereogénicos pero también un plano de simetría, se denomina mesocompuesto.
Estereoespecificidad en síntesis
Hay tres estrategias principales para preparar un solo enantiómero. Hoy discutiremos un ejemplo famoso que toca dos de estos tres métodos:
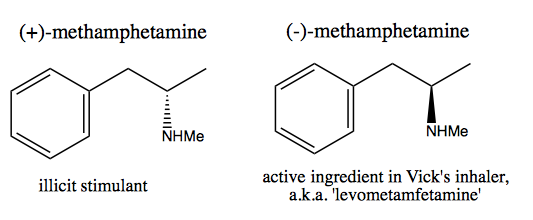
La gente, como Walter White , que desean sintetizar dextrometanfetamina pura para la venta comercial, han desarrollado dos métodos: grupo quiral y resolución.
Grupo quiral
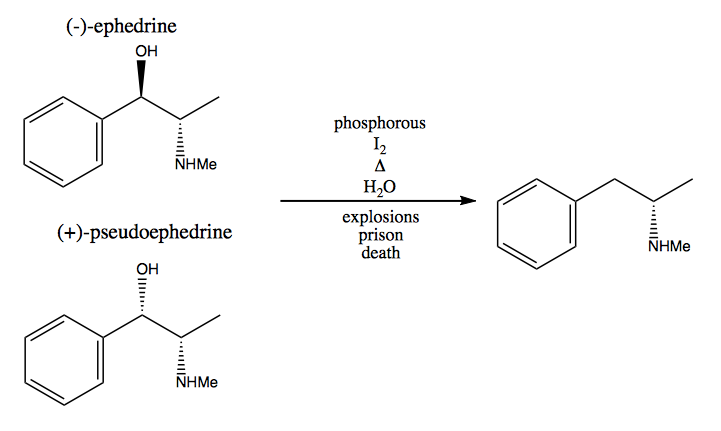
En el método del grupo quiral, se roban centros estereogénicos de la naturaleza. La naturaleza nos proporciona una gran cantidad de moléculas quirales que podemos utilizar como materiales de partida. En el caso de la dextrometanfetamina, puede comenzar con (-) – efedrina o (+) – pseudoefedrina y eliminar el grupo hidroxilo mediante una reacción muy peligrosa:
Resolución
A medida que los esfuerzos de lucha contra las drogas han hecho cada vez más difícil adquirir grandes cantidades de pseudoefedrina, la gente se ha inclinado más hacia el método de resolución. En este método, primero se sintetiza una mezcla racémica:
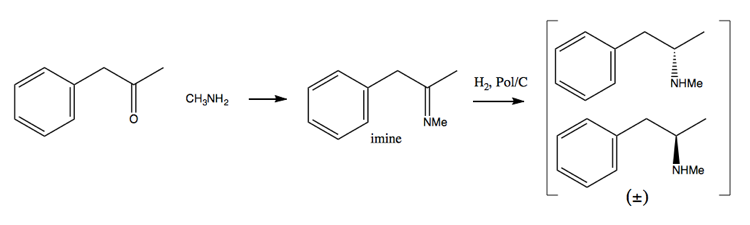
Luego se separa agregando una molécula enantiopura como (+ )-ácido tartárico. (+) – el ácido tartárico formará sales con cada enantiómero, pero las dos sales tienen propiedades físicas diferentes, por lo que, en condiciones cuidadosas, solo puede cristalizar la dextrometanfetamina.
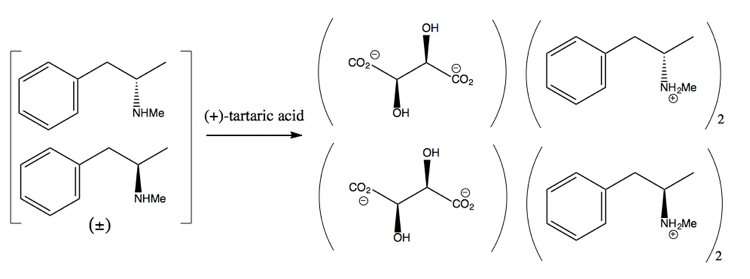
Sin embargo, esto es un desperdicio, ya que en el mejor de los casos se obtiene un rendimiento del 50% y, en la práctica, es difícil obtener incluso tanto.
Quiralidad sin carbono estereogénico
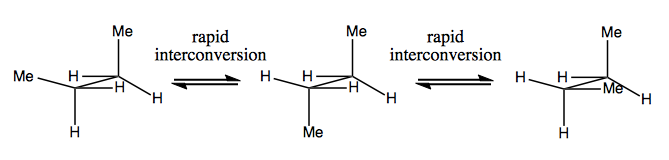
La próxima vez, analizaremos las moléculas que tienen quiralidad sin carbono estereogénico. Por lo general, no son estables y se interconvierten con bastante rapidez. Aquí hay un ejemplo con un nitrógeno estereogénico:
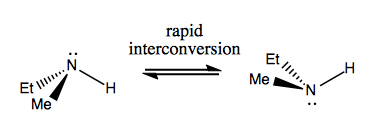
También hay ejemplos extraños en los que una molécula no tiene un solo centro estereogénico, todavía logra ser quiral en general. Por ejemplo, el butano Gauche tiene quiralidad axial aunque ningún carbono es estereogénico. También se interconvierte rápidamente: