To są moje notatki z wykładu 15 z Harvard’s Chemistry 20: Organic Chemistry, wygłoszonego przez dr Ryana Spoeringa 6 marca 2015 r.
Skręcalność optyczna
Fakt, że enancjomery różnie skręcają spolaryzowane światło jest użyteczną właściwością do określania składu mieszaniny, która może znajdować się gdzieś pomiędzy racemicznym (50/50) a czystym (wszystko jeden enancjomer).
W przypadku cząsteczek chiralnych możesz wyszukać wartość o nazwie 20D. 20D oznacza obrót w temperaturze 20 ° C, przy długości drogi 1 dm, w świetle sodowym, gdzie λ = 581 nm (linia D sodu, stąd D). Wielkość ta, wraz z parametrami c = stężenie wg / ml i l = długość drogi, pozwala na wyprowadzenie rzeczywistej rotacji α na podstawie równania 20D = α / (cl).
| ratio | α | ee |
|---|---|---|
| 100: 0 | +12 | 100% |
| 90:10 | +9,6 | 80% |
| 50:50 | 0 | 0% |
Zauważ, że w mieszaninie 90:10, 10 anuluje 10 z 90, więc kończy się tylko 80% obrotu, jaki miałbyś w mieszance 100: 0, dla 80 % ee.
Pasteur i kwas winowy
W 1848 roku Pasteur badał dwie pozornie podobne substancje, kwas winowy i kwas racemiczny. Kwas winowy to naturalna substancja, która czasami krystalizuje z wina i jest prawoskrętna. Kwas racemowy był przemysłowym produktem ubocznym, który wydawał się identyczny z kwasem winowym pod każdym względem, z wyjątkiem tego, że nie miał skręcalności optycznej. Pasteur był witalistą i był bardzo zainteresowany wyjaśnieniem fizycznych podstaw tego, co odróżnia życie od nie-życia. Podejrzewał, że skręcalność optyczna jest specyficzna dla siły życiowej, ponieważ wiele produktów naturalnych było optycznie aktywnych, podczas gdy produkty syntetyczne prawie nigdy nie były.
Pasteur syntetyzował racemiczny kwas amonowo-sodowy, a następnie go krystalizował. Utworzył stos dwóch różnych rodzajów kryształów, które były makroskopowo różne. Za pomocą pęsety i prymitywnego mikroskopu z 1848 r. Można było rozebrać stos na dwa oddzielne stosy kryształów, które były swoim makroskopowym lustrzanym odbiciem. Jeśli następnie ponownie rozpuściłeś dwa stosy, każdy byłby optycznie aktywny, ale w przeciwnych kierunkach.
Teraz wiemy, że bardzo niewiele mieszanin racemicznych zachowuje się w ten sposób. Zdecydowana większość utworzy racemiczny kryształ; tylko garstka tworzy oddzielne kryształy. Co więcej, nawet wiedząc o tym, odtworzenie eksperymentu Pasteura jest w rzeczywistości dość trudne.
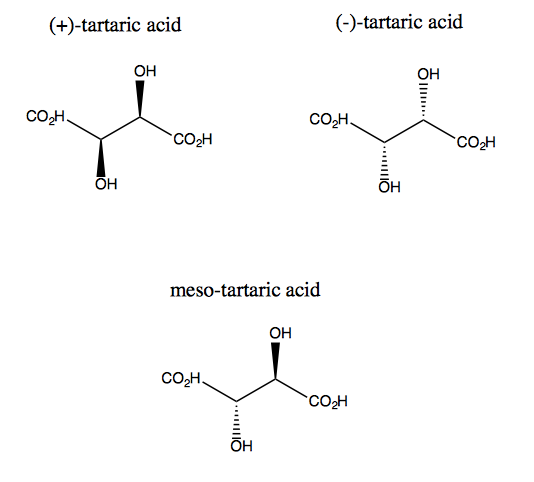
Kwas winowy i jego enancjomer nie mają symetrii płaskiej, chociaż mają one podwójną symetrię obrotową. Nie ma płaszczyzny, na której można by odbijać kwas winowy i nadal go nakładać. Zatem cząsteczka jest chiralna. Jeśli jednak wyobrazisz sobie oś Z wystającą z ekranu, możesz obrócić cząsteczkę o 180 ° wokół tej osi, a następnie nałożyć ją. Nazywa się to symetrią C2. Kwas winowy ma również diastereomer zwany kwasem mezo-winowym. Ta cząsteczka ma płaszczyznę symetrii i dlatego jest achiralna. Ogólnie rzecz biorąc, każdy taki związek posiadający stereogeniczne węgle, ale także płaszczyznę symetrii nazywany jest związkiem mezo.
Stereospecyficzność w syntezie
Istnieją trzy główne strategie przygotowania pojedynczego enancjomeru. Dzisiaj omówimy słynny przykład, który dotyka dwóch z tych trzech metod:
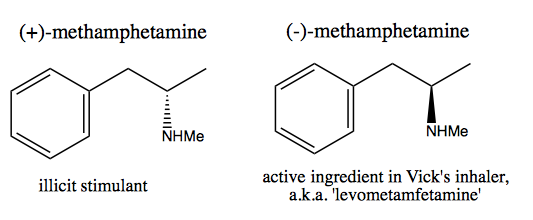
Ludzie, na przykład Walter White , którzy chcą zsyntetyzować czystą dekstrometamfetaminę do sprzedaży komercyjnej, opracowali dwie metody: pulę chiralną i rozdzielczość.
Pula chiralna
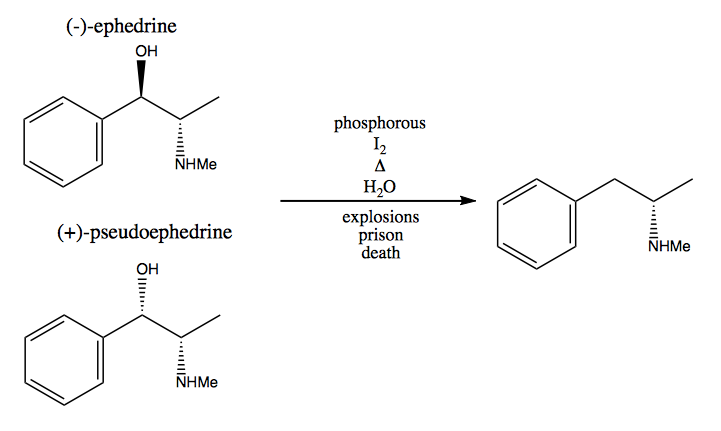
W metodzie chiralnej puli kradniesz z natury centra stereogeniczne. Natura zapewnia nam ogromną pulę chiralnych cząsteczek, których możemy użyć jako materiałów wyjściowych. W przypadku dekstrometamfetaminy możesz zacząć od (-) – efedryny lub (+) – pseudoefedryny i usunąć grupę hydroksylową poprzez bardzo niebezpieczną reakcję:
Rozwiązanie
Ponieważ wysiłki związane z egzekwowaniem narkotyków coraz bardziej utrudniały uzyskanie dużych ilości pseudoefedryny, ludzie zwracali się bardziej w kierunku metody rozwiązania problemu. W tej metodzie najpierw zsyntetyzujesz mieszaninę racemiczną:
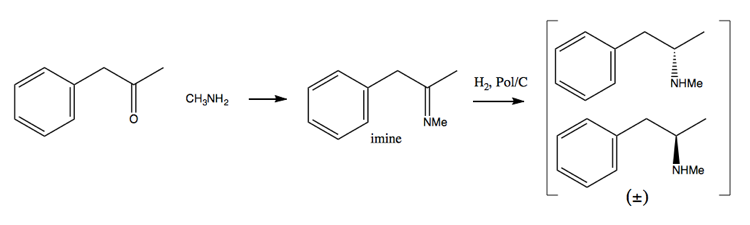
Następnie oddzielasz ją, dodając cząsteczkę enancjomerycznie czystą, taką jak (+ )-kwas winowy. (+) – kwas winowy będzie tworzył sole z każdym enancjomerem, ale te dwie sole mają różne właściwości fizyczne, więc przy ostrożnych warunkach do wykrystalizowania można uzyskać tylko dekstrometamfetaminę.
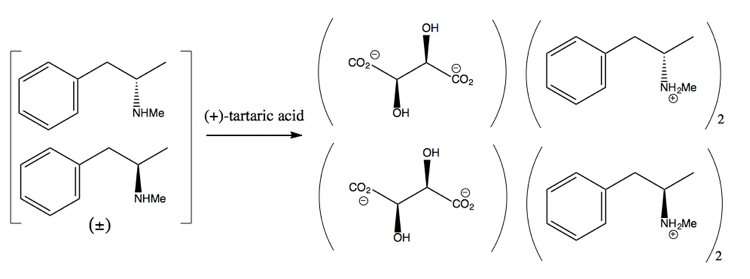
Jest to jednak marnotrawstwo, ponieważ w najlepszym przypadku uzyskuje się 50% zysku, aw praktyce trudno jest uzyskać nawet tyle.
Chiralność bez stereogenicznego węgla
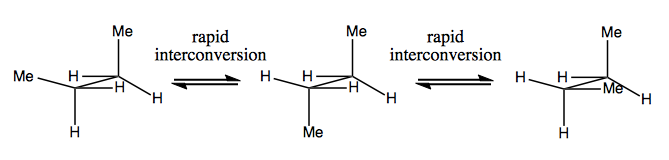
Następnym razem omówimy cząsteczki, które mają chiralność bez stereogenicznego węgla. Zwykle nie są one stabilne i dość szybko przekształcają się wzajemnie. Oto przykład ze stereogennym azotem:
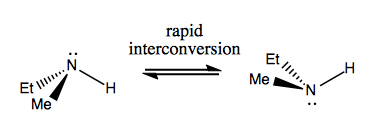
Istnieją również dziwne przykłady, w których cząsteczka nie ma pojedynczego centrum stereogenicznego, ale udaje się być ogólnie chiralny. Na przykład butan Gauche ma osiową chiralność, chociaż żaden węgiel nie jest stereogeniczny. To także szybko się przekształca: