Případ: 73letý muž s anamnézou hypertenze, ischemické choroby srdeční a předchozího myokardu infarkt (MI) představuje na pohotovostním oddělení (ED) únavu, dušnost, snížený výdej moči a otoky kotníku. Po příjezdu mezi jeho vitální funkce patří BP 87/58 mm Hg, HR 102, RR 24, saturace T 86% na vzduchu v místnosti a teplota 98,2 F a při poslechu má praskliny. Jak byste zvládli tohoto pacienta?
Co je kardiogenní šok?
Ačkoli se definice liší, kardiogenní šok (CS) je klinická diagnóza obecně definovaná jako stav nízkého srdečního výdeje s přidruženými nedostatečná perfuze koncových orgánů nebo hypoperfuze tkáně sekundárně k poškození srdce. 1 Běžně používaná kritéria odvozená ze studie SHOCK spočívají v hypotenzi (SBP < 90 mmHg nebo > 90 mmHg s podpůrnou péčí), důkazy o konečném hypoperfúze orgánů a srdeční index (CI) < 2,2 l / min / m2 nebo plicní kapilární klínový tlak ≥ 15 mmHg 2,3 Ačkoli je tato definice užitečná pro standardizaci kritérií pro zařazení do klinických studií , je méně cenné pro diagnostiku CS na pohotovostním oddělení (ED). Při změně zaneprázdněného ED může být CS obtížné diagnostikovat kvůli různým projevům, překrývání s jinými šokovými stavy (tj. Sepse), špatně pochopené patofyziologii, komplexním a multifaktoriálním příčinám a různým hemodynamickým parametrům. 4 (CO) a hodnoty PCWP, CS lze odvodit pomocí důkazů o zvýšených plnicích tlacích (tj. Plicní kongesce nebo zvýšené JVP), klinických známkách hypoperfúze a anamnéze a ozvěně naznačující srdeční selhání. Mortalita sekundární k CS je vysoká (~ 25-70%), ale včasné rozpoznání a intervence zlepšují přežití.4,5 Nouzoví lékaři mají příležitost diagnostikovat CS při přijetí a musí při sledování kriticky nemocného pacienta udržovat vysoké klinické podezření. Tato recenze se zaměří na rozpoznávání a tipy, jak si nenechat ujít diagnózu CS prostřednictvím fyzikálních vyšetření, laboratoří, ultrazvuku u postele a zobrazování.
Jaké jsou příčiny kardiogenního šoku?
Většina studií CS se zaměřuje na pacienty s CS sekundárně po infarktu myokardu (IM) zahrnující levou komoru. Ačkoli jsou primární příčinou CS primární infarkt myokardu (~ 70%), je třeba vzít v úvahu jakoukoli příčinu komorové dysfunkce a sníženého CO nebo srdečního indexu (CO / povrch těla) .6 To zahrnuje, ale není omezeno na: neischemické příčiny selhání pravého srdce, myokarditida, takotsubo kardiomyopatie, hypertrofická kardiomyopatie nebo chlopenní onemocnění srdce (tabulka 1). Aby to bylo ještě náročnější, CS je spíše kontinuum než statický stav, od zhoršení srdečního selhání až po refrakterní šok s nevratným poškozením koncových orgánů (obrázek 1). CS se stává ještě variabilnější s výskytem sekundárních urážek, jako jsou arytmie nebo progresivní ischemie a acidóza.3 Je třeba poznamenat, že ve 2/3 případů není CS přítomný při přijetí, ale později se vyvíjí do 48 hodin od hospitalizace jako pacient postupuje dolů v kontinuu šoku.7 Je důležité často přehodnocovat vitální funkce, příznaky, fyzickou prohlídku a ozvěnu postele u pacientů.

Tabulka 1: Příčiny CS, převzato z Parrillo & Dellinger (2013). 8 70% případů CS je způsobeno akutním IM. 6 Účinky akutního IM se souvisejícími procenta převzatá z výsledků registru SHOCK trial.9.10
Obrázek 1: Kontinuum CS, převzato z Bellumkonda et al . (2018) .3 Toto spektrum se může odchýlit sekundárními urážkami (např. Novými arytmiemi).
Úmrtnost na kardiogenní šok
Přestože sekundární úmrtnost na CS zůstává vysoká, 4 včasné rozpoznání a intervence zlepšuje přežití.5 S využitím údajů, které zahrnovaly registr studií SHOCK, byla 30denní nemocniční úmrtnost 1 217 pacientů, u kterých byla diagnostikována CS sekundárně po selhání levé komory (LV) nebo pravé komory (RV) v důsledku akutního IM, 57% . Pokud vezmete v úvahu několik rizikových faktorů, konkrétně šok při přijetí, věk, předchozí bypass koronární arterie (CABG), noninferiorní IM, kreatinin > 1,9 mg / dL, snížený SBP, anoxický poranění mozku a klinické důkazy hypoperfúze koncových orgánů by pacienti mohli být rozděleni s úmrtností v rozmezí od 12% do 88% .11 Ve studii GRACE CS slabě, ale významně poklesla mezi lety 1999 a 2006, pravděpodobně kvůli zvýšenému používání perkutánního koronární intervence (PCI), důležitá forma včasné intervence u pacientů s infarktem myokardu komplikovaným CS.12 I při stratifikaci pacientů na základě rizikových faktorů byly PCI a CABG přínosem pro pacienty s nízkým i vysokým rizikem.11 Včasná diagnóza a vhodná léčba zůstávají, zejména v případě ischemie myokardu, což je důležitý modifikovatelný přispěvatel k výsledkům u pacientů s CS.
Navíc, čím déle CS postupuje, tím je pravděpodobnější, sekundární reakce na zvýšení cytokinů, jako je TNF-alfa a IL-6, které inhibují srdeční aktivitu. 4,13 Existuje také zvýšení vazopresinu a angiotensinu II, což zvyšuje afterload, zhoršuje CO a zvyšuje retenci vody a solí, což způsobuje plicní edém. Oxid dusnatý (NO) se také zvyšuje aktivací NO syntázy, což vede k vazodilataci a depresi myokardu. Všechny tyto maladaptivní reakce na nízkou hladinu CO a ischemii myokardu vedou ke zhoršení poškození srdeční tkáně, depresivnímu CO a distribučnímu šoku. Je třeba poznamenat, že některé případy CS jsou iatrogenní, když jsou pacienti na pokraji srdečního selhání léčeni agresivními diuretiky, nitráty, betablokátory, ACEI a morfinem. 14 Proto jako první lékař, který hodnotí pacienty, musí lékaři urgentní péče identifikovat a léčit CS časově citlivým a klinicky vhodným způsobem.
Klinické hodnocení
Klasicky jsou pacienti s CS přítomné se stížnostmi na dušnost, bolest na hrudi, únavu a / nebo otok kotníku. špatně prokrvené končetiny (tabulka 2). V malém retrospektivním přehledu 30 pacientů v nediferencovaném šoku měli pacienti s CS častěji JVD (80% ve srovnání s 0% a 20%), studenou pokožku (57,1% ve srovnání s 14,3% a 28,5%) a plicní onemocnění rales (75% proti 16,7% a 8,3%) ve srovnání s pacienty s distribučním a hypovolemickým šokem.16 V jiné prospektivní studii se 68 pacienty použili obyvatelé ke zjištění kategorií šoku specifické nálezy klinických vyšetření. CS byl kategorizován podle SBP méně než 90, známky nízkého výkonu (studené ruce, špatné doplňování kapilár a slabý puls), zvýšený jugulární žilní tlak (JVP) > 7 cmH2O, S3 cval a praskne do 1/3 plic. Ze 68 pacientů splnilo 11 kritérií pro CS. U pacientů s echokardiografickým důkazem nízkého srdečního výdeje předpověděl zvýšený JVP CS s přesností 80%, která se při přidání přítomnosti prasklin nezměnila.17
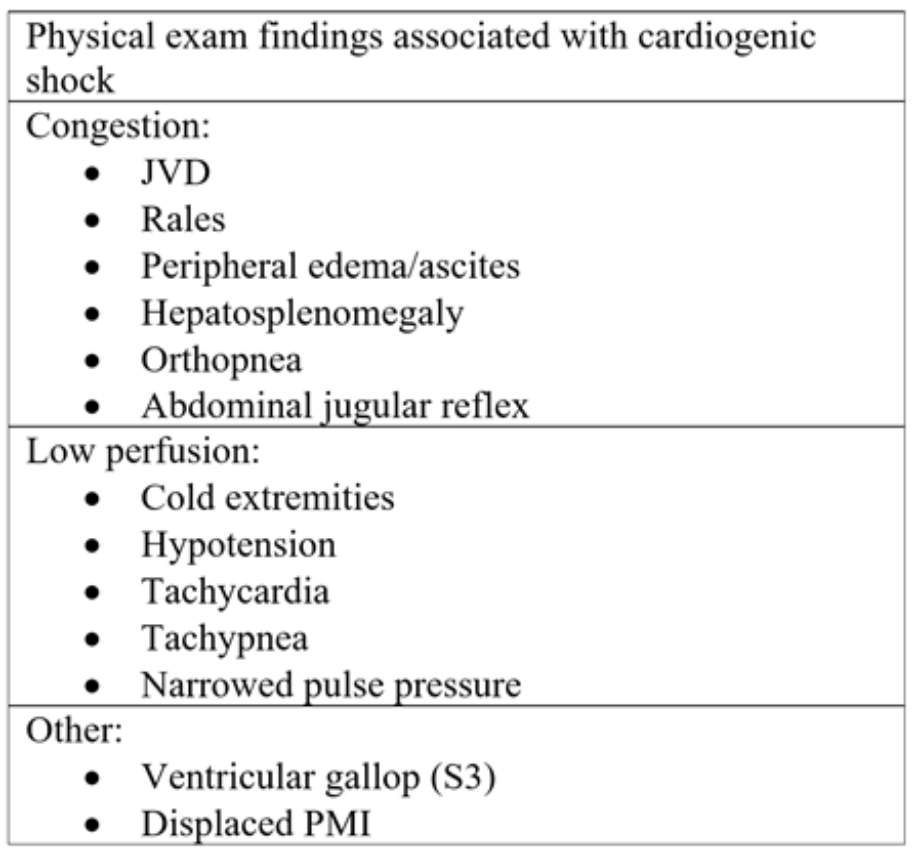
Tabulka 2: Komponenty fyzikálních vyšetření pozorované při akutním srdečním selhání a následném kardiogenním šoku.18
Ačkoli JVP je užitečným zástupcem pro zvýšené klínové tlaky, 19 může být obtížné posoudit vzhledem k tělesnému habitu a umístění pacienta (hlava postele by měla být zvýšena o 45 stupňů, což může být obtížné u pacientů s těžkou ortopnoe) .20 JVP se měří výpočtem nejvyššího bodu pulzace v cm nad úhlem hrudní kosti a poté se přidá 5 (protože pravá síň je 5 cm pod úhlem hrudní kosti), což koreluje s distenzí v cmH20 (obrázek 2). Zvýšené hodnoty jsou často považovány za vyšší než 6-8 cmH20.18 Je třeba poznamenat, že zvýšená JVP je spojena se zvýšeným rizikem úmrtnosti s relativním rizikem (RR) 1,52,18
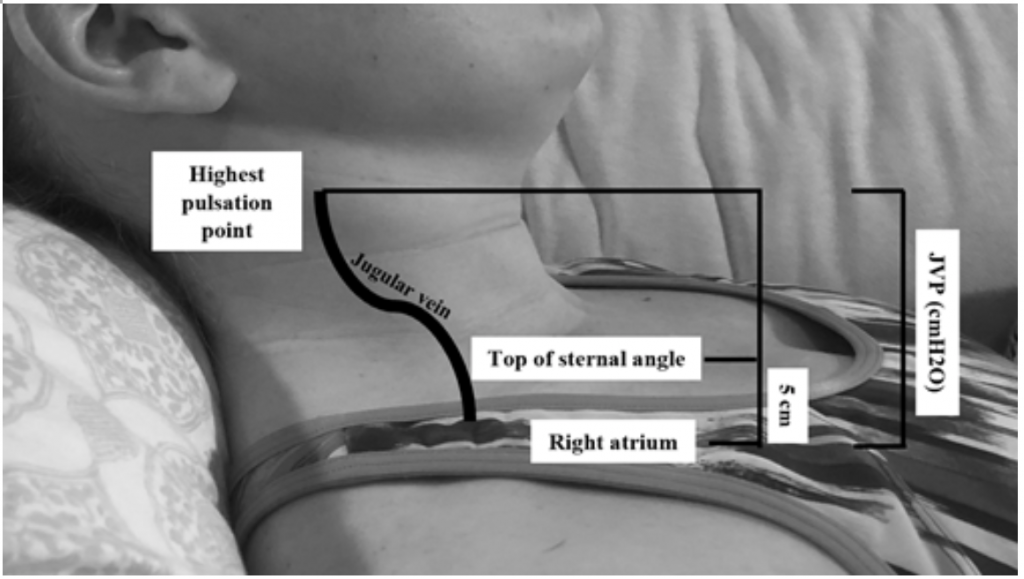
Obrázek 2: Měření JVP, upravené podle Shah & Cowger (2014) .18
Laboratoře se mohou zobrazit metabolická acidóza (s nárůstem laktátu v důsledku periferní ischemie), renální hypoperfuze s výsledným akutním poškozením ledvin a možné důkazy srdeční ischemie se zvýšenými změnami troponinu a EKG.15 Ve studii CardShock byla provedena multicentrická prospektivní observační studie 219 CS u pacientů byly hladiny laktátu významně spojeny se zvýšenou úmrtností (upravený poměr šancí 1,4) .6 Je důležité si uvědomit, že zvýšení laktátu není specifické pro sepsi a lze jej pozorovat v jakémkoli hypoperfúzním stavu, jako je CS.
Na druhou stranu tyto nálezy z fyzikálních vyšetření a hemodynamické parametry nemusí vždy platit. Ve studii využívající registr SHOCK Trial nemělo 5,2% pacientů s CS zjevnou hypotenzi, i když měli známky periferní hypoperfuze a nízké CI.21 Je to pravděpodobně způsobeno adaptivním uvolňováním katecholaminu v časném CS, což zvyšuje systémovou vaskulární rezistenci ( SVR) a přechodně udržuje krevní tlak, i když obecně s úzkým pulzním tlakem.22 I pacienti s klinicky významným plicním edémem při zobrazování mohou mít spíše sípavé nebo dokonce jasné zvuky plic než rales.23 V jedné studii byla plicní kongesce pozorována pouze přibližně 2/3 případů CS sekundárně k MI.21 Navíc, i při snížené kontraktilitě LV, nemusí mít pacienti s CS závažné snížení LVEF. 14,24 Ve skutečnosti je průměrná EF v kohortě pacientů s CS asi 30%, což je sníženo, ale vyšší, než se očekávalo.2
Ačkoli vyšetření není dokonalé, podrobná fyzikální vyšetření zaměřená na známky přetížení a periferní hypoperfuze spolu s pečlivým prohlédnutím vitálních funkcí a laboratoří mohou být první známkou kardiogenního šoku u vašeho pacienta.
ECHO v místě péče pro hodnocení kardiogenního šoku
Když jsou pacienti přítomni u ED hypotenzní nebo hypoperfúzní, je RUSH vyšetření rychlým způsobem, jak odlišit šok při pohledu na „pumpu, nádrž a potrubí. “25,26 U CS transtorakální echokardiogram klasicky demonstruje hypodynamický, rozšířený LV, se špatným squeeze LV a souvisejícím neadekvátní pohybem předního listu mitrální chlopně během systoly a diastoly (tj. špatná kontraktilita). Odhad ejekční frakce (EF) a CO (jako CO = zdvihový objem (SV) x srdeční frekvence (HR)) pouhým „očním koulením“ LV squeeze je adekvátní posouzení lékařů v akutním prostředí.27 V CS je dolní dutina cava (IVC), což je nepřímé měření efektivní intra vaskulární objem, měl by mít průměr > průměr 2 cm a při inspiraci se zhroutí o méně než 50%. Tyto nálezy korelují se zvýšeným centrálním žilním tlakem.28 Hodnocení IVC však může být nepřesné, pokud pacient již užíval vazodilatancia, diuretika a / nebo je ventilován.29 V hrudních oknech se pravděpodobně objeví plicní edém ve formě nadměrného B linie („plicní rakety“), které jsou výsledkem zesílení septa z akumulace vody v intersticiu.30 Spolu s plicní kongescí může být na RUSH zkoušce pleurální a peritoneální tekutina.25 V metaanalýze, která používala data ze tří původních papíry a dvě kazuistiky se ukázalo, že protokol RUSH je v diagnostice CS citlivý i specifický (0,89 resp. 0,97) .31 I přes vysoký výsledný poměr pozitivní pravděpodobnosti (LR) 22,29 byl pouze mírný negativní LR 0,17, což naznačuje, že vyšetření RUSH není dokonalým testem k vyloučení CS. Proto by se vyšetření RUSH mělo používat spíše v kontextu pečlivé anamnézy a fyzické zkoušky, než by se mělo používat samostatně k diagnostice kardiogeni c shock.
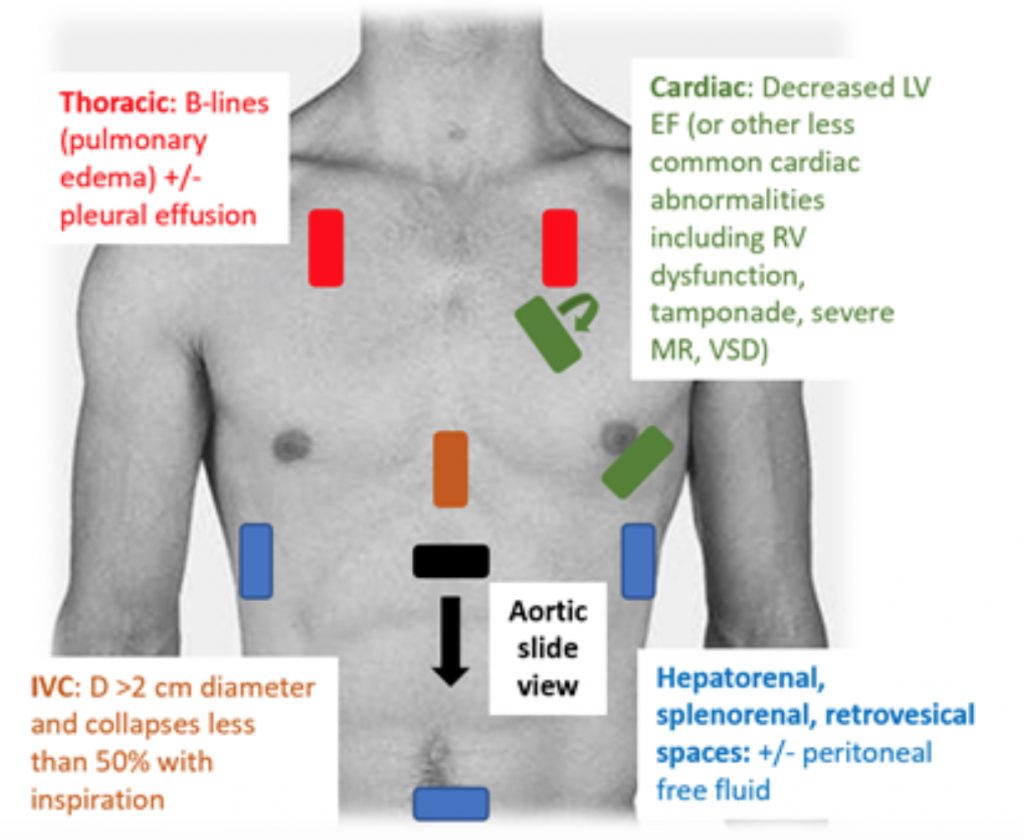
Obrázek 3: RUSH noční vyšetření USA pro hodnocení nediferencované hypotenze se souvisejícími nálezy naznačujícími CS.25 , 26,29,30
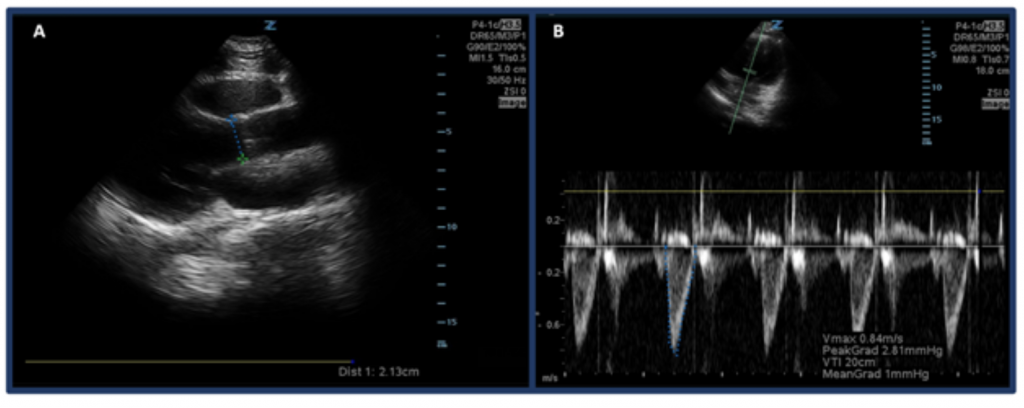
Spíše než jen odhad CO pomocí „oční bulvy“, jedním ze způsobů měření CO pomocí ultrazvuku je nejprve stanovení SV pomocí časového intervalu rychlosti výtokového traktu levé komory (LVOT VTI nebo rychlosti průtoku krve v aortálním výtokovém traktu) a průměr LVOT. Konkrétně SV nebo množství krve vystříknuté levou komorou za úder se vypočítá pomocí plochy LVOT VTI × průřezu LVOT. 32 Chcete-li měřit průměr LVOT, umístěte sondu fázovaného pole do pohledu na parasternální dlouhou osu a změřte vzdálenost LVOT těsně nad aortální chlopní ve střední systole. VTI se měří v apikálně-5komorovém pohledu. Pomocí dopplerového módu pulzních vln je dopplerova vlna umístěna těsně nad aortální chlopní a jsou zaznamenávány dopplerovské tvary vln. Ujistěte se, že je osa zarovnána s výtokovým traktem co nejlépe, abyste předešli nad / pod odhadům. Po výběru měřicího nástroje „LVOT VTI“ změřte průběh jedné ejekční periody. 33,34 Normální LVOT VTI se pohybuje od 18 do 22 cm, i když možná nižší s HRs > 95 tepů za minutu. 35 U pacientů s fibrilací síní bude měření VTI pravděpodobně podhodnocením skutečné hodnoty, a proto se navrhuje zprůměrování 3–5 po sobě jdoucích vlnových křivek. Jak by se dalo očekávat, existuje korelace mezi nízkou LVOT VTI a nepříznivými výsledky.32
Doporučená cesta hodnocení
Jak již bylo uvedeno výše, neexistuje jediný nález na zkoušku nebo laboratorní test, který by mohl diagnostikovat CS. Proto, pokud existuje vysoké podezření na CS při nastavení hypotenze nebo známek hypoperfuze, doporučujeme použít anamnézu, podrobnou fyzikální vyšetření, noční US, laboratoře (konkrétně kreatinin, laktát, troponin, BNP a další markery hypoperfuze / poškození koncových orgánů) a EKG (protože akutní IM je primární příčinou CS a známkami ischemie a může vyžadovat urgentní revaskularizace) na pomoc při diagnostice (viz obrázek 5). Zvažte sledování arteriálního katetru podle TK a proveďte léčbu. Kromě zaměřeného vyšetření srdce a plic by se fyzická prohlídka měla zaměřit na JVD a prokrvení končetin. RUSH zkouška a výpočet EF / CO / CI prostřednictvím měření LVOT VTI diskutovaných výše jsou cennými doplňky hodnocení. Použití komplexního přístupu k vyhodnocení CS umožní lepší porozumění této heterogenní nemoci a pomůže při řízení léčby.
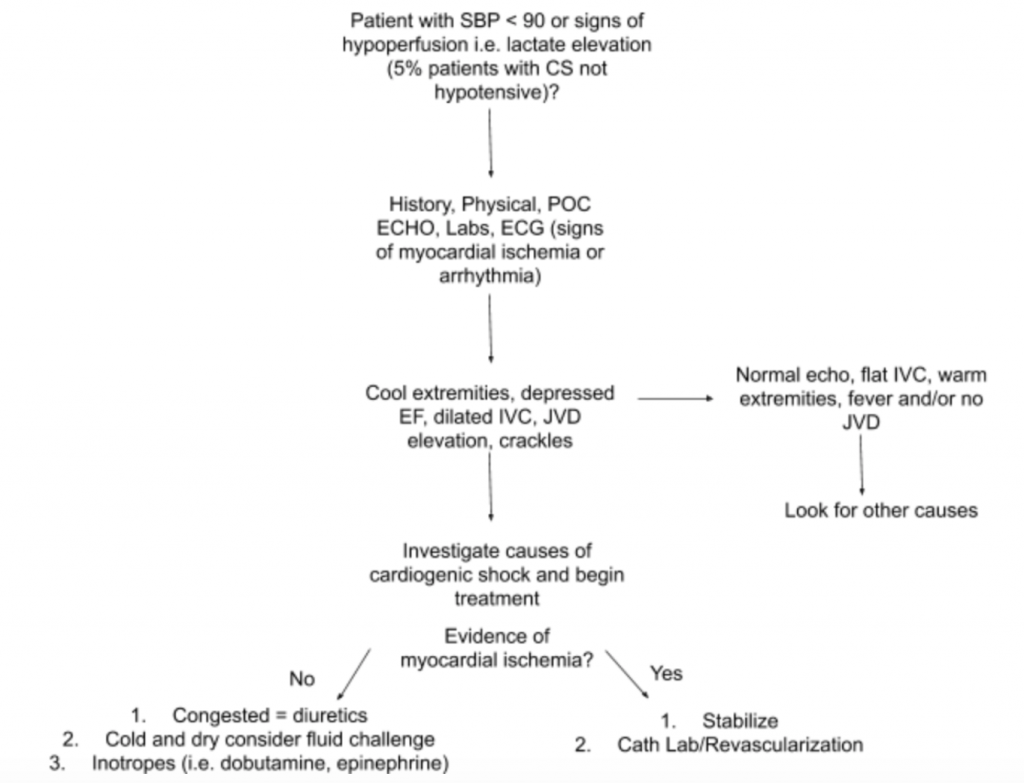
Závěr případu : Při dalším hodnocení je jugulární žilní tlak pacienta zvýšen na 10 cmH20 a jeho nohy jsou v pohodě se zpožděným doplňováním kapilár. Vyšetření RUSH u postele ukazuje bilaterální difúzní plicní edém a odhadovanou nízkou EF.LVOT VTI se měří pouze na 10 cm. EKG ukazuje elevace ST v prekordiálních svodech. Laktát a troponin jsou mírně zvýšené. Pacient je stabilizován krátkou studií s dobutaminem, i.v. furosemidem a CPAP s mírným zlepšením životních funkcí a stavu dýchání a následně je odeslán do katetrizační laboratoře na naléhavé PCI.
Vezměte si domácí body:
- CS je primárně způsobena akutním IM (~ 70%) a je předmětem většiny studií, ale je třeba vzít v úvahu i jiné příčiny (viz úplný seznam na obrázku 1).
- Mortalita sekundární vůči CS zůstává vysoká (~ 60%), ačkoli včasná identifikace a intervence zlepšují přežití.
- Proveďte pečlivou fyzickou prohlídku a vyhledejte hypoperfúzi a dopravní zácpy. JVP je důležitou složkou fyzikální zkoušky pro diagnostiku CS a je spojena se zvýšenou úmrtností (RR = 1,52).
- Zkouška RUSH je citlivá i specifická (0,89 resp. 0,97) v diagnostice CS. Ultrazvuk u lůžka by se měl často opakovat, protože většina pacientů se zpočátku v CS nevyskytuje.
- Použití LVOT VTI je jednoduchá a neinvazivní metoda pro hodnocení CO s nízkým měřením spojeným s nepříznivými výsledky.
- Navrhovaný přístup k hodnocení pacientů s podezřením na CS se zaměřením na jeho heterogenní patologii a prezentaci je shrnut na obrázku 5.
Pěnové zdroje:
- EM v 5 : Shock
- emDocs: Cardiogenic Shock
- emDocs: ED Management of Heart Failure- Perly and Pitfalls
- emDocs: RUSH („Rapid Ultrasound for Shock“) Protocol
- emDocs: Hypotenzivní pacient s ED: sekvenční systematický přístup
- Prvních 10 EM: nediferencovaná hypotenze
