Även om alla atomer i ett element har samma antal protoner, kan atomerna skilja sig åt i antalet neutroner de har (Tabell 1-2). Dessa olika atomer av samma element kallas isotoper. Fyra isotoper av helium (He) visas i figur 1-1. Alla kloratomer (Cl) har 17 protoner, men det finns klorisotoper med 15 till 23 neutroner. Endast två klorisotoper finns i betydande mängder i naturen, de med 18 neutroner (75,53% av alla kloratomer som finns i naturen) och de med 20 neutroner (24,47%). För att skriva symbolen för en isotop, placera atomnumret som ett underskrift och massnumret (protoner plus neutroner) som ett överskrift till vänster om atomsymbolen. Symbolerna för de två naturligt förekommande isotoperna av klor skulle då vara  Cl och
Cl och 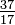 Cl. Strikt taget är abonnemanget onödigt, eftersom alla kloratomer har 17 protoner. Därför är isotopsymbolerna vanligtvis skrivna utan abonnemanget: 35Cl och 37Cl. När vi diskuterar dessa isotoper använder vi. termer klor-35 och klor-37. För att en kärna ska vara stabil bör antalet neutroner (för de första elementen) vara lika med eller överstiga antalet protoner. Ju fler protoner, desto större är förhållandet mellan neutroner och protoner för att säkerställa stabilitet. Kärnor som har för många av båda typerna av grundläggande partiklar är instabila och bryts ned radioaktivt på sätt som diskuteras i kapitel 23.
Cl. Strikt taget är abonnemanget onödigt, eftersom alla kloratomer har 17 protoner. Därför är isotopsymbolerna vanligtvis skrivna utan abonnemanget: 35Cl och 37Cl. När vi diskuterar dessa isotoper använder vi. termer klor-35 och klor-37. För att en kärna ska vara stabil bör antalet neutroner (för de första elementen) vara lika med eller överstiga antalet protoner. Ju fler protoner, desto större är förhållandet mellan neutroner och protoner för att säkerställa stabilitet. Kärnor som har för många av båda typerna av grundläggande partiklar är instabila och bryts ned radioaktivt på sätt som diskuteras i kapitel 23.

Exempel 1.2.1
Hur många protoner, neutroner och elektroner finns det i en atom med den mest stabila isotopen av uran, uran-238? Skriv symbolen för denna isotop. Se figur. 1-1.
Lösning
Atanantalet på uran (se insidan på baksidan) är 92, och isotopens massnummer anges som 238. Därför har det 92 protoner, 92 elektroner och 238 – 92 = 146 neutroner. Dess symbol är  U (eller 238U).
U (eller 238U).
En atoms totala massa kallas dess atomvikt, och detta är nästan men inte exakt summan av massorna av dess ingående protoner, neutroner och elektroner. * När protoner, neutroner och elektroner kombineras för att bilda en atom omvandlas en del av deras massa till energi och avges. (Detta är energikällan i kärnfusionsreaktioner.) Eftersom atomen inte kan brytas ned i dess grundläggande partiklar om inte energin för den saknade massan tillförs från utsidan kallas denna energi kärnans bindande energi. p>
Anmärkning: Atomvikt vs. atommassa
Termerna atomvikt och molekylvikt används allmänt av arbetande forskare och kommer att användas i den här boken, även om dessa är tekniskt massor snarare än vikter.
| Elektroner | Protoner | Neutroner |
Atomic Number |
Atomic Weight (amu) |
Total laddning (elektronenheter) |
|
|---|---|---|---|---|---|---|
| Väteatom, 1H eller H | 1 | 1 | 0 | 1 | 1.008 | 0 |
| Deuteriumatom, 2H eller D | 1 | 1 | 1 | 1 | 2.014 | 0 |
| Tritiumatom, 3H eller T | 1 | 1 | 2 | 1 | 3.016 | 0 |
| Vätejon, H + | 0 | 1 | 0 | 1 | 1.007 | +1 |
| Heliumatom, 4He | 2 | 2 | 2 | 2 | 4.003 | 0 |
| Heliumkärna eller alfapartikel, He2 + eller α | 0 | 2 | 2 | 2 | 4.002 | +2 |
| Litiumatom, 7Li | 3 | 3 | 4 | 3 | 7.016 | 0 |
| Kolatom, 12Ca | 6 | 6 | 6 | 6 | 12.000 | 0 |
| Syreatom, 16O | 8 | 8 | 8 | 8 | 15.995 | 0 |
| Kloratom, 35Cl | 17 | 17 | 18 | 17 | 34.969 | 0 |
| Kloratom, 37Cl | 17 | 17 | 20 | 17 | 36.966 | 0 |
| Naturligt förekommande blandning av klor | 17 | 17 | 18 eller 20 | 17 | 35.453 | 0 |
| Uranatom, 234U | 92 | 92 | 142 | 92 | 234.04 | 0 |
| Uranatom, 235U | 92 | 92 | 143 | 92 | 235.04 | 0 |
| Uranatom, 238U | 92 | 92 | 146 | 92 | 238.05 | 0 |
| Naturligt förekommande blandning av uran | 92 | 92 | varierad | 92 | 238.03 | 0 |
Exempel 1.2. 2
Beräkna massan som går förlorad när en atom av kol-12 bildas av protoner, elektroner och neutroner.
Lösning
Eftersom atomnu av varje kolatom är 6, kol-12 har 6 protoner och därför 6 elektroner. För att hitta antalet neutroner subtraherar vi antalet protoner från massantalet: 12 – 6 = 6 neutroner. Vi kan använda uppgifterna i tabell 1-1 för att beräkna den totala massan av dessa partiklar:
| Protoner: | 6 X 1.00728 amu = 6.04368 amu |
| Neutroner: | 6 X 1.00867 amu = 6.05202 amu |
| Elektroner: | 6 X 0,00055 amu = 0,00330 amu |
| Total partikelmassa: 12.09900 amu |
Men enligt definitionen av skalans atommasseenheter är massan av en kol-12-atom exakt 12 amu. Därför har 0,0990 amu massa försvunnit i processen att bygga atomen från dess partiklar.
Exempel 1.2.3
Beräkna den förväntade atomvikten för isotop av klor som har 20 neutroner. Jämför detta med den aktuella atomvikten för denna isotop enligt tabell 1-2.
Lösning
Klorisotopen har 17 protoner och 20 neutroner:
| Protoner: | 17 X 1.00728 amu = | 17.1238 amu |
| Neutroner: | 20 X 1.00867 amu = | 20.1734 amu |
| Elektroner: | 17 X 0,00055 amu = | 0,0094 amu |
| Total partikelmassa: | 37,3066 amu | |
| Faktisk observerad atomvikt: | 36.966 amu | |
| Massförlust: | 0,341 amu |
Varje isotop av ett element kännetecknas av ett atomnummer (totalt antal protoner), ett massnummer (totalt antal protoner s och neutroner) och en atomvikt (atommassa i atommasseenheter). Eftersom massförlusterna vid bildandet av en atom är små är massantalet vanligtvis detsamma som atomvikten avrundad till närmaste heltal. (Till exempel är atomvikten för klor-37 36.966, vilket är avrundad till 37.) Om det finns flera isotoper av ett element i naturen kommer naturligtvis den experimentellt observerade atomvikten (den naturliga atomvikten) att vägas genomsnittet av isotopvikterna. Genomsnittet viktas enligt det procentuella överflödet av isotoperna. Klor förekommer i naturen som 75,53% klor-35 (34,97 amu) och 24,47% klor-37 (36,97 amu), så det vägda genomsnittet av isotopvikterna är
\
atomvikter som ges på baksidan av denna bok är alla viktade medelvärden för de isotoper som förekommer i naturen, och det är de siffror som vi kommer att använda i fortsättningen – såvida vi inte specifikt diskuterar en isotop. Alla isotoper av ett element beter sig på samma sätt kemiskt för det mesta. Deras beteende kommer att skilja sig åt med avseende på masskänsliga egenskaper som diffusionshastigheter, som vi kommer att titta på senare i den här boken.
Exempel 1.2.4
Magnesium ( Mg) har tre signifikanta naturliga isotoper: 78,70% av alla magnesiumatomer har en atomvikt på 23,985 amu, 10,13% har en atomvikt på 24,986 amu och 11,17% har en atomvikt på 25,983 amu. Hur många protoner och neutroner är närvarande i var och en av dessa tre isotoper? Hur skriver vi symbolerna för varje isotop? Slutligen, vad är det viktade genomsnittet av atomvikterna?
Lösning
Det finns totalt 12 protoner magnesiumisotoper. Isotopen vars atomvikt är 23,985 amu har ett massantal på 24 (protoner och neutroner), så 24 – 12 protoner ger 12 neutroner. Symbolen för denna isotop är 24 mg. På samma sätt är isotopen vars atomvikt är 24.986 amu har ett massnummer på 25, 13 neutroner och 25Mg som symbol. Den tredje isotopen (25.983 amu) har ett massantal på 26, 14 neutroner och 26Mg som symbol. Vi beräknar den genomsnittliga atomvikten enligt följande:
(0.7870 X 23.985) + (0.1013 X 24.986) + (0.1117 X 25.983) = 24.31 amu
Exempel 1.2.5
Bor har två naturligt förekommande isotoper, lOB och 11B. Vi vet att 80,22% av dess atomer är 11B, atomvikt 11,009 amu. Beräkna atomvikten för LOB-isotopen ur den naturliga atomvikten som anges på insidan av baksidan.
Lösning
Om 80,22% av alla boratomer är 11B, är 100,00 – 80,22 , eller 19,78%, är den okända isotopen. Vi kan använda W för att representera den okända atomvikten i vår beräkning:
(0,8022 X 11,009) + (0,1978 XW) = 10,81 amu (naturlig atomvikt) W =  = 10,01 amu
= 10,01 amu
Bidragare och tillskrivningar
-
R. E. Dickerson, HB Gray och GP Haight, Jr. Innehållet användes från ”Chemical Principles”, en inledande högskolanivå för Allmän kemi med tillstånd från Caltech-biblioteket och Harry B. Gray, för författarnas räkning. / p>
