Embora todos os átomos de um elemento tenham o mesmo número de prótons, os átomos podem diferir no número de nêutrons que possuem (Tabela 1-2). Esses átomos diferentes do mesmo elemento são chamados de isótopos. Quatro isótopos de hélio (He) são mostrados na Figura 1-1. Todos os átomos de cloro (Cl) têm 17 prótons, mas existem isótopos de cloro com 15 a 23 nêutrons. Apenas dois isótopos de cloro existem em quantidades significativas na natureza, aqueles com 18 nêutrons (75,53% de todos os átomos de cloro encontrados na natureza) e aqueles com 20 nêutrons (24,47%). Para escrever o símbolo de um isótopo, coloque o número atômico como um subscrito e o número de massa (prótons mais nêutrons) como um sobrescrito à esquerda do símbolo atômico. Os símbolos para os dois isótopos de cloro que ocorrem naturalmente seriam  Cl e
Cl e 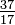 Cl. A rigor, o subscrito é desnecessário, pois todos os átomos de cloro têm 17 prótons. Portanto, os símbolos de isótopos são geralmente escritos sem o subscrito: 35Cl e 37Cl. Ao discutir esses isótopos, usamos o. termos cloro-35 e cloro-37. Para um núcleo ser estável, o número de nêutrons deve (para os primeiros elementos) ser igual ou ligeiramente superior ao número de prótons. Quanto mais prótons, maior a proporção de nêutrons para prótons para garantir a estabilidade. Os núcleos que possuem muitos de qualquer tipo de partícula fundamental são instáveis e se rompem radioativamente das maneiras que são discutidas no Capítulo 23.
Cl. A rigor, o subscrito é desnecessário, pois todos os átomos de cloro têm 17 prótons. Portanto, os símbolos de isótopos são geralmente escritos sem o subscrito: 35Cl e 37Cl. Ao discutir esses isótopos, usamos o. termos cloro-35 e cloro-37. Para um núcleo ser estável, o número de nêutrons deve (para os primeiros elementos) ser igual ou ligeiramente superior ao número de prótons. Quanto mais prótons, maior a proporção de nêutrons para prótons para garantir a estabilidade. Os núcleos que possuem muitos de qualquer tipo de partícula fundamental são instáveis e se rompem radioativamente das maneiras que são discutidas no Capítulo 23.

Exemplo 1.2.1
Quantos prótons, nêutrons e elétrons existem em um átomo do isótopo mais estável do urânio, o urânio-238? Escreva o símbolo para este isótopo. Consulte a Figura. 1-1.
Solução
O número atômico do urânio (veja a contracapa) é 92, e o número de massa do isótopo é 238. Portanto, ele tem 92 prótons, 92 elétrons e 238 – 92 = 146 nêutrons. Seu símbolo é  U (ou 238U).
U (ou 238U).
A massa total de um átomo é chamada de peso atômico, e isso é quase, mas não exatamente a soma das massas de seus prótons, nêutrons e elétrons constituintes. * Quando prótons, nêutrons e elétrons se combinam para formar um átomo, parte de sua massa é convertida em energia e é emitida. (Esta é a fonte de energia nas reações de fusão nuclear.) Como o átomo não pode ser dividido em suas partículas fundamentais, a menos que a energia para a massa ausente seja fornecida de fora dele, essa energia é chamada de energia de ligação do núcleo.
Nota: Peso Atômico vs. Massa Atômica
Os termos peso atômico e peso molecular são usados universalmente por cientistas em atividade e serão usados neste livro, embora sejam tecnicamente massas em vez de pesos.
| Elétrons | Prótons | Neutrons |
Atômico Número |
Peso atômico (amu) |
Carga total (unidades do elétron) |
|
|---|---|---|---|---|---|---|
| Átomo de hidrogênio, 1H ou H | 1 | 1 | 0 | 1 | 1,008 | 0 |
| Átomo de deutério, 2H ou D | 1 | 1 | 1 | 1 | 2.014 | 0 |
| Átomo de trítio, 3H ou T | 1 | 1 | 2 | 1 | 3,016 | 0 |
| íon hidrogênio, H + | 0 | 1 | 0 | 1 | 1,007 | +1 |
| átomo de hélio, 4He | 2 | 2 | 2 | 2 | 4,003 | 0 |
| Núcleo de hélio ou partícula alfa, He2 + ou α | 0 | 2 | 2 | 2 | 4,002 | +2 |
| Átomo de lítio, 7Li | 3 | 3 | 4 | 3 | 7.016 | 0 |
| Átomo de carbono, 12Ca | 6 | 6 | 6 | 6 | 12.000 | 0 |
| Átomo de oxigênio, 16O | 8 | 8 | 8 | 8 | 15,995 | 0 |
| Átomo de cloro, 35Cl | 17 | 17 | 18 | 17 | 34.969 | 0 |
| Átomo de cloro, 37Cl | 17 | 17 | 20 | 17 | 36,966 | 0 |
| Mistura natural de cloro | 17 | 17 | 18 ou 20 | 17 | 35,453 | 0 |
| Átomo de urânio, 234U | 92 | 92 | 142 | 92 | 234,04 | 0 |
| Átomo de urânio, 235U | 92 | 92 | 143 | 92 | 235,04 | 0 |
| Átomo de urânio, 238U | 92 | 92 | 146 | 92 | 238,05 | 0 |
| Mistura de urânio que ocorre naturalmente | 92 | 92 | variada | 92 | 238,03 | 0 |
Exemplo 1.2. 2
Calcule a massa que é perdida quando um átomo de carbono-12 é formado a partir de prótons, elétrons e nêutrons.
Solução
Já que o nu atômico mber de cada átomo de carbono é 6, o carbono-12 tem 6 prótons e, portanto, 6 elétrons. Para encontrar o número de nêutrons, subtraímos o número de prótons do número de massa: 12 – 6 = 6 nêutrons. Podemos usar os dados da Tabela 1-1 para calcular a massa total dessas partículas:
| Prótons: | 6 X 1.00728 amu = 6.04368 amu |
| Nêutrons: | 6 X 1,00867 amu = 6,05202 amu |
| Elétrons: | 6 X 0,00055 amu = 0,00330 amu |
| Massa total das partículas: 12,09900 amu |
Mas pela definição da escala das unidades de massa atômica, a massa de um átomo de carbono-12 é exatamente 12 amu. Portanto, 0,0990 amu de massa desapareceu no processo de construção do átomo a partir de suas partículas.
Exemplo 1.2.3
Calcule o peso atômico esperado do isótopo de cloro que possui 20 nêutrons. Compare isso com o peso atômico real deste isótopo, conforme apresentado na Tabela 1-2.
Solução
O isótopo de cloro tem 17 prótons e 20 nêutrons:
| Prótons: | 17 X 1,00728 amu = | 17,1238 amu |
| Nêutrons: | 20 X 1,00867 amu = | 20,1734 amu |
| Elétrons: | 17 X 0,00055 amu = | 0,0094 amu |
| Massa total das partículas: | 37,3066 amu | |
| Peso atômico real observado: | 36,966 amu | |
| Perda de massa: | 0,341 amu |
Cada isótopo de um elemento é caracterizado por um número atômico (número total de prótons), um número de massa (número total de prótons se nêutrons), e um peso atômico (massa do átomo em unidades de massa atômica). Como as perdas de massa na formação de um átomo são pequenas, o número da massa é geralmente o mesmo que o peso atômico arredondado para o número inteiro mais próximo. (Por exemplo, o peso atômico do cloro-37 é 36,966, que é arredondado para 37.) Se houver vários isótopos de um elemento na natureza, é claro que o peso atômico experimentalmente observado (o peso atômico natural) será o ponderado média dos pesos dos isótopos. A média é ponderada de acordo com a abundância percentual dos isótopos. O cloro ocorre na natureza como 75,53% cloro-35 (34,97 amu) e 24,47% cloro-37 (36,97 amu), então a média ponderada dos pesos dos isótopos é
\
O os pesos atômicos fornecidos na contracapa deste livro são todos médias ponderadas dos isótopos que ocorrem na natureza, e esses são os números que usaremos daqui em diante – a menos que estejamos discutindo especificamente um isótopo. Todos os isótopos de um elemento se comportam quimicamente da mesma maneira em sua maior parte. Seu comportamento será diferente em relação às propriedades sensíveis à massa, como taxas de difusão, que veremos mais tarde neste livro.
Exemplo 1.2.4
Magnésio ( Mg) tem três isótopos naturais significativos: 78,70% de todos os átomos de magnésio têm um peso atômico de 23,985 amu, 10,13% têm um peso atômico de 24,986 uma e 11,17% têm um peso atômico de 25,983 uma. Quantos prótons e nêutrons estão presentes em cada um desses três isótopos? Como escrevemos os símbolos para cada isótopo? Finalmente, qual é a média ponderada dos pesos atômicos?
Solução
Existem 12 prótons ao todo isótopos de magnésio. O isótopo cujo peso atômico é 23,985 amu tem um número de massa de 24 (prótons e nêutrons), então 24 – 12 prótons dá 12 nêutrons. O símbolo para este isótopo é 24 mg. Da mesma forma, o isótopo cujo peso atômico é 24986 amu tem um número de massa de 25, 13 nêutrons e 25Mg como um símbolo. O terceiro isótopo (25,983 amu) tem um número de massa de 26, 14 nêutrons e 26Mg como um símbolo. Calculamos o peso atômico médio da seguinte forma:
(0,7870 X 23,985) + (0,1013 X 24,986) + (0,1117 X 25,983) = 24,31 amu
Exemplo 1.2.5
O boro tem dois isótopos naturais, lOB e 11B. Sabemos que 80,22% de seus átomos são 11B, peso atômico 11,009 amu. A partir do peso atômico natural fornecido na contracapa interna, calcule o peso atômico do isótopo 10B.
Solução
Se 80,22% de todos os átomos de boro são 11B, então 100,00 – 80,22 , ou 19,78%, são o isótopo desconhecido. Podemos usar W para representar o peso atômico desconhecido em nosso cálculo:
(0,8022 X 11,009) + (0,1978 XW) = 10,81 amu (peso atômico natural) W =  = 10,01 amu
= 10,01 amu
Contribuidores e atribuições
-
R. E. Dickerson, HB Gray e GP Haight, Jr. O conteúdo foi usado de “Princípios Químicos”, um texto introdutório de nível universitário para Química Geral com permissão da biblioteca Caltech e Harry B. Gray, em nome dos autores.
