Selvom alle atomer i et element har det samme antal protoner, kan atomerne variere i antallet af neutroner, de har (tabel 1-2). Disse forskellige atomer af det samme element kaldes isotoper. Fire helotisotoper (He) er vist i figur 1-1. Alle kloratomer (Cl) har 17 protoner, men der er klorisotoper med 15 til 23 neutroner. Kun to klorisotoper findes i betydelige mængder i naturen, dem med 18 neutroner (75,53% af alle kloratomer, der findes i naturen), og dem med 20 neutroner (24,47%). For at skrive symbolet for en isotop skal du placere atomnummeret som et underskrift og massetallet (protoner plus neutroner) som et overskrift til venstre for atomsymbolet. Symbolerne for de to naturligt forekommende isotoper af klor ville så være  Cl og
Cl og 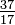 Cl. Strengt taget er abonnementet unødvendigt, da alle kloratomer har 17 protoner. Derfor er isotopsymbolerne normalt skrevet uden abonnementet: 35Cl og 37Cl. Når vi diskuterer disse isotoper, bruger vi. betegner chlor-35 og chlor-37. For at en kerne skal være stabil, skal antallet af neutroner (for de første par elementer) være lig med eller lidt større end antallet af protoner. Jo flere protoner, jo større er forholdet mellem neutroner og protoner for at sikre stabilitet. Kerner, der har for mange af begge slags grundlæggende partikler, er ustabile og nedbrydes radioaktivt på måder, der diskuteres i kapitel 23.
Cl. Strengt taget er abonnementet unødvendigt, da alle kloratomer har 17 protoner. Derfor er isotopsymbolerne normalt skrevet uden abonnementet: 35Cl og 37Cl. Når vi diskuterer disse isotoper, bruger vi. betegner chlor-35 og chlor-37. For at en kerne skal være stabil, skal antallet af neutroner (for de første par elementer) være lig med eller lidt større end antallet af protoner. Jo flere protoner, jo større er forholdet mellem neutroner og protoner for at sikre stabilitet. Kerner, der har for mange af begge slags grundlæggende partikler, er ustabile og nedbrydes radioaktivt på måder, der diskuteres i kapitel 23.

Eksempel 1.2.1
Hvor mange protoner, neutroner og elektroner er der i et atom af den mest stabile isotop af uran, uran-238? Skriv symbolet for denne isotop. Se figur. 1-1.
Løsning
Atantallet for uran (se det indvendige bagdæksel) er 92, og isotopens massetal er angivet som 238. Derfor har det 92 protoner, 92 elektroner og 238 – 92 = 146 neutroner. Dets symbol er  U (eller 238U).
U (eller 238U).
Den samlede masse af et atom kaldes dets atomvægt, og dette er næsten men ikke nøjagtigt summen af masserne af dets sammensatte protoner, neutroner og elektroner. * Når protoner, neutroner og elektroner kombineres for at danne et atom, konverteres noget af deres masse til energi og afgives. (Dette er energikilden i atomfusionsreaktioner.) Da atomet ikke kan nedbrydes i dets grundlæggende partikler, medmindre energien til den manglende masse tilføres udefra, kaldes denne energi kernens bindingsenergi. p>
Bemærk: Atomvægt vs. atommasse
Udtrykkene atomvægt og molekylvægt bruges universelt af arbejdende forskere og vil blive brugt i denne bog, selvom disse er teknisk masser snarere end vægte.
| Elektroner | Protoner | Neutroner |
Atomisk Antal |
Atomvægt (amu) |
Total opladning (elektronenheder) |
|
|---|---|---|---|---|---|---|
| Brintatom, 1H eller H | 1 | 1 | 0 | 1 | 1.008 | 0 |
| Deuteriumatom, 2H eller D | 1 | 1 | 1 | 1 | 2.014 | 0 |
| Tritiumatom, 3H eller T | 1 | 1 | 2 | 1 | 3.016 | 0 |
| Hydrogenion, H + | 0 | 1 | 0 | 1 | 1.007 | +1 |
| Heliumatom, 4He | 2 | 2 | 2 | 2 | 4.003 | 0 |
| Heliumkerne eller alfapartikel, He2 + eller α | 0 | 2 | 2 | 2 | 4.002 | +2 |
| Lithiumatom, 7Li | 3 | 3 | 4 | 3 | 7.016 | 0 |
| Carbonatom, 12Ca | 6 | 6 | 6 | 6 | 12.000 | 0 |
| Oxygenatom, 16O | 8 | 8 | 8 | 8 | 15.995 | 0 |
| Kloratom, 35Cl | 17 | 17 | 18 | 17 | 34.969 | 0 |
| Kloratom, 37Cl | 17 | 17 | 20 | 17 | 36.966 | 0 |
| Naturligt forekommende blanding af klor | 17 | 17 | 18 eller 20 | 17 | 35.453 | 0 |
| Uranatom, 234U | 92 | 92 | 142 | 92 | 234,04 | 0 |
| Uranatom, 235U | 92 | 92 | 143 | 92 | 235.04 | 0 |
| Uranatom, 238U | 92 | 92 | 146 | 92 | 238,05 | 0 |
| Naturligt forekommende blanding af uran | 92 | 92 | varieret | 92 | 238.03 | 0 |
Eksempel 1.2. 2
Beregn den masse, der går tabt, når et atom af carbon-12 dannes af protoner, elektroner og neutroner.
Løsning
Siden atom nu mber af hvert kulstofatom er 6, carbon-12 har 6 protoner og derfor 6 elektroner. For at finde antallet af neutroner trækker vi antallet af protoner fra massetallet: 12 – 6 = 6 neutroner. Vi kan bruge dataene i tabel 1-1 til at beregne den samlede masse af disse partikler:
| Protoner: | 6 X 1.00728 amu = 6.04368 amu |
| Neutroner: | 6 X 1.00867 amu = 6.05202 amu |
| Elektroner: | 6 X 0,00055 amu = 0,00330 amu |
| Samlet partikelmasse: 12.09900 amu |
Men efter definitionen af skalaen for atommasseenheder er massen af et carbon-12-atom nøjagtigt 12 amu. Derfor er 0,0990 amu masse forsvundet i processen med at opbygge atomet fra dets partikler.
Eksempel 1.2.3
Beregn den forventede atomvægt af isotop af klor, der har 20 neutroner. Sammenlign dette med den aktuelle atomvægt af denne isotop som angivet i tabel 1-2.
Løsning
Klorisotopen har 17 protoner og 20 neutroner:
| Protoner: | 17 X 1.00728 amu = | 17.1238 amu |
| Neutroner: | 20 X 1.00867 amu = | 20.1734 amu |
| Elektroner: | 17 X 0.00055 amu = | 0.0094 amu |
| Samlet partikelmasse: | 37,3066 amu | |
| Faktisk observeret atomvægt: | 36.966 amu | |
| Massetab: | 0,341 amu |
Hver isotop af et element er kendetegnet ved et atomnummer (total antal protoner), et massetal (total antal proton s og neutroner) og en atomvægt (atomets masse i atommasseenheder). Da massetab ved dannelse af et atom er lille, er massetallet normalt det samme som atomvægten afrundet til nærmeste heltal. (F.eks. Er atomvægten af chlor-37 36.966, som afrundes til 37.) Hvis der er flere isotoper af et element i naturen, vil den eksperimentelt observerede atomvægt (den naturlige atomvægt) naturligvis være den vægtede gennemsnit af isotopvægtene. Gennemsnittet vægtes i overensstemmelse med den procentvise overflod af isotoperne. Klor forekommer i naturen som 75,53% chlor-35 (34,97 amu) og 24,47% chlor-37 (36,97 amu), så det vejede gennemsnit af isotopvægtene er
\
atomvægte, der er angivet på bagsiden af denne bog, er alle vejede gennemsnit af de isotoper, der forekommer i naturen, og det er de tal, vi skal bruge fremover, medmindre vi specifikt diskuterer en isotop. Alle isotoper af et element opfører sig for det meste kemisk på samme måde. Deres adfærd vil variere med hensyn til massefølsomme egenskaber såsom diffusionshastigheder, som vi vil se på senere i denne bog.
Eksempel 1.2.4
Magnesium ( Mg) har tre betydelige naturlige isotoper: 78,70% af alle magnesiumatomer har en atomvægt på 23,985 amu, 10,13% har en atomvægt på 24,986 amu og 11,17% har en atomvægt på 25,983 amu. Hvor mange protoner og neutroner er til stede i hver af disse tre isotoper? Hvordan skriver vi symbolerne for hver isotop? Endelig, hvad er det vægtede gennemsnit af atomvægtene?
Løsning
Der er i alt 12 protoner magnesiumisotoper. Isotopen, hvis atomvægt er 23.985 amu, har et massetal på 24 (protoner og neutroner), så 24 – 12 protoner giver 12 neutroner. Symbolet for denne isotop er 24 mg. Tilsvarende er den isotop, hvis atomvægt er 24.986 amu har et massetal på 25, 13 neutroner og 25Mg som symbol. Den tredje isotop (25.983 amu) har et massetal på 26, 14 neutroner og 26Mg som symbol. Vi beregner den gennemsnitlige atomvægt som følger:
(0.7870 X 23.985) + (0.1013 X 24.986) + (0.1117 X 25.983) = 24.31 amu
Eksempel 1.2.5
Bor har to naturligt forekommende isotoper, LOB og 11B. Vi ved, at 80,22% af dets atomer er 11B, atomvægt 11,009 amu. Ud fra den naturlige atomvægt, der er angivet på indersiden af bagdækslet, skal du beregne atomvægten af lOB-isotopen.
Løsning
Hvis 80,22% af alle boratomer er 11B, så er 100,00 – 80,22 , eller 19,78%, er den ukendte isotop. Vi kan bruge W til at repræsentere den ukendte atomvægt i vores beregning:
(0.8022 X 11.009) + (0.1978 XW) = 10.81 amu (naturlig atomvægt) W =  = 10,01 amu
= 10,01 amu
Bidragere og tilskrivninger
-
R. E. Dickerson, HB Gray og GP Haight, Jr. Indhold blev brugt fra “Chemical Principles”, en indledende tekst på college-niveau til generel kemi med tilladelse fra Caltech-biblioteket og Harry B. Gray på vegne af forfatterne. / p>
