Selv om alle atomer i et element har samme antall protoner, kan atomene variere i antall nøytroner de har (tabell 1-2). Disse forskjellige atomer av samme element kalles isotoper. Fire isotoper av helium (He) er vist i figur 1-1. Alle kloratomer (Cl) har 17 protoner, men det er klorisotoper som har 15 til 23 nøytroner. Bare to klorisotoper finnes i betydelige mengder i naturen, de med 18 nøytroner (75,53% av alle kloratomer som finnes i naturen), og de med 20 nøytroner (24,47%). For å skrive symbolet for en isotop, plasser atomnummeret som et underskrift og massetallet (protoner pluss nøytroner) som et overskrift til venstre for atomsymbolet. Symbolene for de to naturlig forekommende isotoper av klor ville da være  Cl og
Cl og 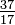 Cl. Strengt tatt er abonnementet unødvendig, siden alle kloratomer har 17 protoner. Derfor blir isotopsymbolene vanligvis skrevet uten abonnementet: 35Cl og 37Cl. Når vi diskuterer disse isotoper, bruker vi. betegner klor-35 og klor-37. For at en kjerne skal være stabil, bør antall nøytroner (for de første elementene) være lik eller litt større enn antall protoner. Jo flere protoner, jo større er forholdet mellom nøytroner og protoner for å sikre stabilitet. Kjerner som har for mange av begge grunnleggende partikler er ustabile og brytes ned radioaktivt på måter som er diskutert i kapittel 23.
Cl. Strengt tatt er abonnementet unødvendig, siden alle kloratomer har 17 protoner. Derfor blir isotopsymbolene vanligvis skrevet uten abonnementet: 35Cl og 37Cl. Når vi diskuterer disse isotoper, bruker vi. betegner klor-35 og klor-37. For at en kjerne skal være stabil, bør antall nøytroner (for de første elementene) være lik eller litt større enn antall protoner. Jo flere protoner, jo større er forholdet mellom nøytroner og protoner for å sikre stabilitet. Kjerner som har for mange av begge grunnleggende partikler er ustabile og brytes ned radioaktivt på måter som er diskutert i kapittel 23.

Eksempel 1.2.1
Hvor mange protoner, nøytroner og elektroner er det i et atom med den mest stabile isotopen av uran, uran-238? Skriv symbolet for denne isotopen. Se figur. 1-1.
Løsning
Atomtallet på uran (se innsiden av bakdekselet) er 92, og massetallet på isotopen er gitt som 238. Derfor har den 92 protoner, 92 elektroner og 238 – 92 = 146 nøytroner. Symbolet er  U (eller 238U).
U (eller 238U).
Den totale massen til et atom kalles dets atomvekt, og dette er nesten men ikke nøyaktig summen av massene av dets protoner, nøytroner og elektroner. * Når protoner, nøytroner og elektroner kombineres for å danne et atom, konverteres noe av massen til energi og avgis. (Dette er energikilden i kjernefusjonsreaksjoner.) Fordi atomet ikke kan brytes ned i dets grunnleggende partikler med mindre energien for den manglende massen tilføres fra utsiden, kalles denne energien kjernens bindende energi. p>
Merk: Atomic Weight vs. Atomic Mass
Begrepene atomvekt og molekylvekt brukes universelt av forskere som arbeider, og vil bli brukt i denne boka, selv om disse er teknisk masse i stedet for vekter.
| Elektroner | Protoner | Nøytroner |
Atomisk Antall |
Atomvekt (amu) |
Total ladning (elektronenheter) |
|
|---|---|---|---|---|---|---|
| Hydrogenatom, 1H eller H | 1 | 1 | 0 | 1 | 1.008 | 0 |
| Deuteriumatom, 2H eller D | 1 | 1 | 1 | 1 | 2.014 | 0 |
| Tritiumatom, 3H eller T | 1 | 1 | 2 | 1 | 3.016 | 0 |
| Hydrogenion, H + | 0 | 1 | 0 | 1 | 1.007 | +1 |
| Heliumatom, 4He | 2 | 2 | 2 | 2 | 4.003 | 0 |
| Heliumkjerne eller alfapartikkel, He2 + eller α | 0 | 2 | 2 | 2 | 4.002 | +2 |
| Litiumatom, 7Li | 3 | 3 | 4 | 3 | 7.016 | 0 |
| Karbonatom, 12Ca | 6 | 6 | 6 | 6 | 12.000 | 0 |
| Oksygenatom, 16O | 8 | 8 | 8 | 8 | 15.995 | 0 |
| Kloratom, 35Cl | 17 | 17 | 18 | 17 | 34.969 | 0 |
| Kloratom, 37Cl | 17 | 17 | 20 | 17 | 36.966 | 0 |
| Naturlig forekommende blanding av klor | 17 | 17 | 18 eller 20 | 17 | 35.453 | 0 |
| Uranatom, 234U | 92 | 92 | 142 | 92 | 234.04 | 0 |
| Uranatom, 235U | 92 | 92 | 143 | 92 | 235.04 | 0 |
| Uranatom, 238U | 92 | 92 | 146 | 92 | 238.05 | 0 |
| Naturlig forekommende blanding av uran | 92 | 92 | variert | 92 | 238.03 | 0 |
Eksempel 1.2. 2
Beregn massen som går tapt når et atom av karbon-12 dannes fra protoner, elektroner og nøytroner.
Løsning
Siden atomnu av hvert karbonatom er 6, karbon-12 har 6 protoner og derfor 6 elektroner. For å finne antall nøytroner trekker vi antall protoner fra massetallet: 12 – 6 = 6 nøytroner. Vi kan bruke dataene i tabell 1-1 for å beregne den totale massen av disse partiklene:
| Protoner: | 6 X 1.00728 amu = 6.04368 amu |
| Nøytroner: | 6 X 1.00867 amu = 6.05202 amu |
| Elektroner: | 6 X 0,00055 amu = 0,00330 amu |
| Total partikkelmasse: 12.09900 amu |
Men etter definisjonen av skalaen til atommasseenheter er massen av ett karbon-12-atom nøyaktig 12 amu. Derfor har 0,0990 amu masse forsvunnet i prosessen med å bygge atomet fra partiklene.
Eksempel 1.2.3
Beregn den forventede atomvekten til isotop av klor som har 20 nøytroner. Sammenlign dette med den faktiske atomvekten til denne isotopen som gitt i tabell 1-2.
Løsning
Klorisotopen har 17 protoner og 20 nøytroner:
| Protoner: | 17 X 1.00728 amu = | 17.1238 amu |
| Nøytroner: | 20 X 1.00867 amu = | 20.1734 amu |
| Elektroner: | 17 X 0.00055 amu = | 0.0094 amu |
| Total partikkelmasse: | 37,3066 amu | |
| Faktisk observert atomvekt: | 36.966 amu | |
| Massetap: | 0,341 amu |
Hver isotop av et element er preget av et atomnummer (totalt antall protoner), et massetall (totalt antall proton s og nøytroner), og en atomvekt (atomens masse i atommasseenheter). Siden massetap ved dannelse av et atom er lite, er massetallet vanligvis det samme som atomvekten avrundet til nærmeste heltall. (For eksempel er atomvekten til klor-37 36.966, som er avrundet til 37.) Hvis det er flere isotoper av et element i naturen, vil selvfølgelig den eksperimentelt observerte atomvekten (den naturlige atomvekten) være vektet gjennomsnittet av isotopvektene. Gjennomsnittet vektes i henhold til prosentvis overflod av isotopene. Klor forekommer i naturen som 75,53% klor-35 (34,97 amu) og 24,47% klor-37 (36,97 amu), så det vektede gjennomsnittet av isotopvektene er
\
atomvekter gitt på baksiden av denne boken er alle vektede gjennomsnitt av isotoper som forekommer i naturen, og dette er figurene vi skal bruke fremover, med mindre vi spesifikt diskuterer en isotop. Alle isotoper av et element oppfører seg på samme måte kjemisk for det meste. Deres oppførsel vil variere med hensyn til massesensitive egenskaper som diffusjonshastigheter, som vi vil se på senere i denne boka.
Eksempel 1.2.4
Magnesium ( Mg) har tre betydelige naturlige isotoper: 78,70% av alle magnesiumatomer har en atomvekt på 23,985 amu, 10,13% har en atomvekt på 24,986 amu, og 11,17% har en atomvekt på 25,983 amu. Hvor mange protoner og nøytroner er til stede i hver av disse tre isotoper? Hvordan skriver vi symbolene for hver isotop? Til slutt, hva er det vektede gjennomsnittet av atomvektene?
Løsning
Det er 12 protoner i alt magnesiumisotoper. Isotopen med atomvekt er 23,985 amu har et massetall på 24 (protoner og nøytroner), så 24 – 12 protoner gir 12 nøytroner. Symbolet for denne isotopen er 24 mg. Tilsvarende er isotopen hvis atomvekt er 24.986 amu har et massetall på 25, 13 nøytroner og 25Mg som symbol. Den tredje isotopen (25.983 amu) har et massetall på 26, 14 nøytroner og 26Mg som symbol. Vi beregner den gjennomsnittlige atomvekten som følger:
(0.7870 X 23.985) + (0.1013 X 24.986) + (0.1117 X 25.983) = 24.31 amu
Eksempel 1.2.5
Bor har to naturlig forekommende isotoper, LOB og 11B. Vi vet at 80,22% av atomene er 11B, atomvekt 11,009 amu. Beregn atomvekten til LOB-isotopen fra den naturlige atomvekten gitt på innsiden av bakdekselet.
Løsning
Hvis 80,22% av alle boratomer er 11B, er 100,00 – 80,22 , eller 19,78%, er den ukjente isotopen. Vi kan bruke W til å representere den ukjente atomvekten i beregningen vår:
(0.8022 X 11.009) + (0.1978 XW) = 10.81 amu (naturlig atomvekt) W =  = 10,01 amu
= 10,01 amu
Bidragsytere og attribusjoner
-
R. E. Dickerson, HB Gray og GP Haight, Jr. Innhold ble brukt fra «Chemical Principles», en innledende tekst på college-nivå for generell kjemi med tillatelse fra Caltech-biblioteket og Harry B. Gray, på vegne av forfatterne. / p>
