Vaikka elementin kaikilla atomeilla on sama määrä protoneja, atomit voivat poiketa neutronien lukumäärästä (taulukko 1-2). Näitä saman elementin erilaisia atomeja kutsutaan isotoopeiksi. Neljä heliumin isotooppia (He) on esitetty kuvassa 1-1. Kaikilla kloorin (Cl) atomeilla on 17 protonia, mutta on kloori-isotooppeja, joissa on 15 – 23 neutronia. Luonnossa on merkittäviä määriä vain kaksi kloori-isotooppia, 18 neutronia sisältäviä (75,53% kaikista luonnossa esiintyvistä klooriatomeista) ja 20 neutronia sisältäviä (24,47%). Voit kirjoittaa isotoopin symbolin sijoittamalla atominumeron alaindeksiin ja massanumeron (protonit plus neutronit) yläindeksiin atomisymbolin vasemmalle puolelle. Sitten kahden luonnossa esiintyvän kloorin isotoopin symbolit olisivat  Cl ja
Cl ja 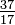 Cl. Tarkkaan ottaen alaindeksi on tarpeeton, koska kaikilla klooriatomeilla on 17 protonia. Siksi isotooppisymbolit kirjoitetaan yleensä ilman alaindeksiä: 35Cl ja 37Cl. Keskustellessamme näistä isotoopeista käytämme. termit kloori-35 ja kloori-37. Jotta ydin olisi vakaa, neutronien lukumäärän (muutamien ensimmäisten alkuaineiden kohdalla) tulisi olla yhtä suuri tai hieman suurempi kuin protonien. Mitä enemmän protoneja, sitä suurempi on neutronien suhde protoneihin vakauden varmistamiseksi. Ytimet, joissa on liikaa jommankumman tyyppistä peruspartikkelia, ovat epävakaita ja hajoavat radioaktiivisesti tavalla, jota käsitellään luvussa 23.
Cl. Tarkkaan ottaen alaindeksi on tarpeeton, koska kaikilla klooriatomeilla on 17 protonia. Siksi isotooppisymbolit kirjoitetaan yleensä ilman alaindeksiä: 35Cl ja 37Cl. Keskustellessamme näistä isotoopeista käytämme. termit kloori-35 ja kloori-37. Jotta ydin olisi vakaa, neutronien lukumäärän (muutamien ensimmäisten alkuaineiden kohdalla) tulisi olla yhtä suuri tai hieman suurempi kuin protonien. Mitä enemmän protoneja, sitä suurempi on neutronien suhde protoneihin vakauden varmistamiseksi. Ytimet, joissa on liikaa jommankumman tyyppistä peruspartikkelia, ovat epävakaita ja hajoavat radioaktiivisesti tavalla, jota käsitellään luvussa 23.

Esimerkki 1.2.1
Kuinka monta protonia, neutronia ja elektronia on uraanin vakain isotoopin, uraani-238: n, atomi? Kirjoita tämän isotoopin symboli. Katso kuva. 1-1.
Ratkaisu
Uraanin atomiluku (katso takakannen sisäpuoli) on 92 ja isotoopin massanumero on 238. Siksi sillä on 92 protoneja, 92 elektronia ja 238 – 92 = 146 neutronia. Sen symboli on  U (tai 238U).
U (tai 238U).
Atomin kokonaispainoa kutsutaan sen atomipainoksi, ja tämä on melkein mutta ei täsmälleen sen muodostavien protonien, neutronien ja elektronien massojen summa. * Kun protonit, neutronit ja elektronit yhdistyvät muodostaen atomin, osa niiden massasta muuttuu energiaksi ja vapautuu. (Tämä on energialähde ydinfuusioreaktioissa.) Koska atomia ei voida hajottaa sen perushiukkasiksi, ellei energiaa puuttuvaa massaa varten toimiteta sen ulkopuolelta, tätä energiaa kutsutaan ytimen sitovaksi energiaksi. p>
Huomaa: Atomipaino vs. atomimassa
Työntekijät käyttävät yleisesti termejä atomipaino ja molekyylipaino, ja niitä käytetään tässä kirjassa, vaikka ne ovatkin teknisesti massat eikä painot.
| elektronit | Protonit | Neutronit |
Atomic Numero |
Atomipaino (amu) |
Kokonaislataus (elektroniyksiköt) |
|
|---|---|---|---|---|---|---|
| vetyatomi, 1H tai H | 1 | 1 | 0 | 1 | 1.008 | 0 |
| Deuteriumatomi, 2H tai D | 1 | 1 | 1 | 1 | 2.014 | 0 |
| Tritiumatomi, 3H tai T | 1 | 1 | 2 | 1 | 3.016 | 0 |
| Vetyioni, H + | 0 | 1 | 0 | 1 | 1.007 | +1 |
| heliumiatomi, 4He | 2 | 2 | 2 | 2 | 4.003 | 0 |
| heliumydin tai alfa-hiukkanen, He2 + tai α | 0 | 2 | 2 | 2 | 4.002 | +2 |
| Litiumatomi, 7Li | 3 | 3 | 4 | 3 | 7.016 | 0 |
| hiiliatomi, 12Ca | 6 | 6 | 6 | 6 | 12.000 | 0 |
| happiatomi, 16O | 8 | 8 | 8 | 8 | 15,995 | 0 |
| klooriatomi, 35Cl | 17 | 17 | 18 | 17 | 34.969 | 0 |
| klooriatomi, 37Cl | 17 | 17 | 20 | 17 | 36.966 | 0 |
| Luonnossa esiintyvä klooriseos | 17 | 17 | 18 tai 20 | 17 | 35.453 | 0 |
| uraaniatomi, 234U | 92 | 92 | 142 | 92 | 234.04 | 0 |
| uraaniatomi, 235U | 92 | 92 | 143 | 92 | 235.04 | 0 |
| Uraaniatomi, 238U | 92 | 92 | 146 | 92 | 238,05 | 0 |
| Luonnossa esiintyvä uraaniseos | 92 | 92 | vaihteli | 92 | 238.03 | 0 |
Esimerkki 1.2. 2
Laske massa, joka menetetään, kun hiili-12-atomi muodostuu protoneista, elektronista ja neutronista.
Ratkaisu
Koska atomin nu Jokaisen hiiliatomin mber on 6, hiili-12: lla on 6 protonia ja siten 6 elektronia. Neutronien lukumäärän löytämiseksi vähennämme protonien lukumäärän massaluvusta: 12 – 6 = 6 neutronia. Voimme käyttää taulukon 1-1 tietoja näiden hiukkasten kokonaispainon laskemiseen:
| Protonit: | 6 X 1.00728 amu = 6.04368 amu |
| Neutronit: | 6 X 1.00867 amu = 6.05202 amu |
| Elektronit: | 6 X 0,00055 amu = 0,00330 amu |
| Hiukkasten kokonaismassa: 12,09900 amu |
Mutta atomimassayksiköiden mittakaavan määritelmän mukaan yhden hiili-12-atomin massa on tarkalleen 12 amu. Siksi 0,0990 amu massaa on kadonnut atomin rakentamisen hiukkasista.
Esimerkki 1.2.3
Laske odotetun atomipainon kloorin isotooppi, jossa on 20 neutronia. Vertaa tätä tämän isotoopin todelliseen atomipainoon taulukon 1-2 mukaisesti.
Ratkaisu
Kloori-isotoopilla on 17 protonia ja 20 neutronia:
| Protonit: | 17 X 1,00728 amu = | 17.1238 amu |
| Neutronit: | 20 X 1,00867 amu = | 20.1734 amu |
| Elektronit: | 17 X 0,00055 amu = | 0,0094 amu |
| Hiukkasten kokonaismassa: | 37.3066 amu | |
| Todellinen havaittu atomipaino: | 36.966 amu | |
| Tappio: | 0,341 amu |
Jokaiselle elementin isotoopille on tunnusomaista atomiluku (protonien kokonaismäärä), massanumero (protonien kokonaismäärä) s ja neutronit) ja atomipaino (atomin massa atomimassayksikköinä). Koska massahäviöt atomin muodostuessa ovat pieniä, massanumero on yleensä sama kuin atomipaino pyöristettynä lähimpään kokonaislukuun. (Esimerkiksi kloori-37: n atomipaino on 36,966, joka pyöristetään 37: een.) Jos luonnossa on useita elementin isotooppeja, niin tietenkin kokeellisesti havaittu atomipaino (luonnollinen atomipaino) painotetaan. isotooppipainojen keskiarvo. Keskiarvo painotetaan isotooppien prosentuaalisen runsauden mukaan. Klooria esiintyy luonnossa 75,53% kloori-35: nä (34,97 amu) ja 24,47% kloori-37: nä (36,97 amu), joten isotooppipainotusten painotettu keskiarvo on
\
tämän kirjan takakannen sisällä annetut atomipainot ovat kaikki painotettuja keskiarvoja luonnossa esiintyvistä isotoopeista, ja näitä lukuja käytämme vastedes – ellei keskustella erikseen yhdestä isotoopista. Elementin kaikki isotoopit käyttäytyvät suurimmaksi osaksi samalla tavalla kemiallisesti. Heidän käyttäytymisensä eroavat massaherkkien ominaisuuksien, kuten diffuusionopeuksien, suhteen, joita tarkastelemme myöhemmin tässä kirjassa.
Esimerkki 1.2.4
Magnesium ( Mg): llä on kolme merkittävää luonnollista isotooppia: 78,70% kaikista magnesiumatomista on atomipaino 23,985 amu, 10,13% on atomipaino 24,986 amu ja 11,17% on atomipaino 25,983 amu. Kuinka monta protonia ja neutronia on läsnä kummassakin näistä kolmesta isotoopista? Kuinka kirjoitetaan kunkin isotoopin symbolit? Lopuksi, mikä on atomipainojen painotettu keskiarvo?
Ratkaisu
Kaikissa on 12 protonia magnesium-isotoopit. Isotoopin, jonka atomipaino on 23,985 amu, massanumero on 24 (protonit ja neutronit), joten 24 – 12 protonia antaa 12 neutronia. Tämän isotoopin symboli on 24 Mg. Vastaavasti isotooppi, jonka atomipaino on 24.986 amu: n massaluku on 25, 13 neutronia ja 25 Mg symbolina. Kolmannen isotoopin (25,983 amu) massaluku on 26, 14 neutronia ja 26Mg symbolina. Laskemme keskimääräisen atomipainon seuraavasti:
(0.7870 X 23.985) + (0.1013 X 24.986) + (0.1117 X 25.983) = 24.31 amu
Esimerkki 1.2.5 p Boorissa on kaksi luonnossa esiintyvää isotooppia, lOB ja 11B. Tiedämme, että 80,22% sen atomista on 11B, atomipaino 11,009 amu. Laske takakannen sisäpuolella olevan luonnollisen atomipainon perusteella LOB-isotoopin atomipaino.
Ratkaisu
Jos 80,22% kaikista booriatomeista on 11B, niin 100,00 – 80,22 eli 19,78% ovat tuntematon isotooppi. Voimme käyttää W: tä edustamaan tuntematonta atomipainoa laskelmissamme:
(0,8022 X 11,009) + (0,1978 XW) = 10,81 amu (luonnollinen atomipaino) W =  = 10.01 amu
= 10.01 amu
Avustajat ja attribuutit
-
R. E. Dickerson, HB Grey ja GP Haight, Jr. Sisältöä käytettiin julkaisusta ”Chemical Principles”, joka on yleiskemian johdanto yliopistotason tekstistä Caltechin kirjaston ja Harry B. Grayn luvalla kirjoittajien puolesta. / p>
