Bár egy elem összes atomjának azonos a protonjainak száma, az atomok eltérhetnek a neutronok számától (1-2. Táblázat). Ugyanazon elem ezen eltérő atomjait izotópoknak nevezzük. A hélium négy izotópját (He) az 1-1. Ábra mutatja. A klór (Cl) összes atomjának 17 protonja van, de vannak olyan klór-izotópok, amelyekben 15–23 neutron található. Csak két klór-izotóp létezik jelentős mennyiségben a természetben, azok, amelyeknek 18 neutronja van (a természetben található összes klóratom 75,53% -a), és azoké, amelyekben 20 neutron van (24,47%). Egy izotóp szimbólumának megírásához helyezze az atomszámot indexként, a tömegszámot (protonok és neutronok) pedig felső indexként az atomi szimbólumtól balra. A két természetesen előforduló klór-izotóp szimbólumai ekkor  Cl és
Cl és 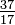 Cl szimbólumok lennének. Szigorúan véve az alindex felesleges, mivel a klór összes atomjának 17 protonja van. Ezért az izotópszimbólumokat általában al index nélkül írják: 35Cl és 37Cl. Ezen izotópok tárgyalása során a. klór-35 és klór-37 kifejezéseket jelent. Ahhoz, hogy a sejtmag stabil legyen, a neutronok számának (az első néhány elem esetében) meg kell egyeznie vagy kissé meghaladja a protonok számát. Minél több proton van, annál nagyobb a neutronok és a protonok aránya a stabilitás biztosítása érdekében. Azok az atommagok, amelyekben túl sok az egyik alapvető részecske, instabilak és radioaktív módon lebomlanak a 23. fejezetben tárgyalt módon.
Cl szimbólumok lennének. Szigorúan véve az alindex felesleges, mivel a klór összes atomjának 17 protonja van. Ezért az izotópszimbólumokat általában al index nélkül írják: 35Cl és 37Cl. Ezen izotópok tárgyalása során a. klór-35 és klór-37 kifejezéseket jelent. Ahhoz, hogy a sejtmag stabil legyen, a neutronok számának (az első néhány elem esetében) meg kell egyeznie vagy kissé meghaladja a protonok számát. Minél több proton van, annál nagyobb a neutronok és a protonok aránya a stabilitás biztosítása érdekében. Azok az atommagok, amelyekben túl sok az egyik alapvető részecske, instabilak és radioaktív módon lebomlanak a 23. fejezetben tárgyalt módon.

1.2.1. Példa
Hány proton, neutron és elektron van az urán legstabilabb izotópjának egy atomja, az urán-238? Írja be ennek az izotópnak a szimbólumát. Lásd: ábra. 1-1.
Megoldás
Az urán atomszáma 92 (lásd a hátsó borító belső oldalát) 92, az izotóp tömegszáma pedig 238. protonok, 92 elektron és 238 – 92 = 146 neutron. Jelképe:  U (vagy 238U).
U (vagy 238U).
Az atom teljes tömegét atomtömegének nevezzük, és ez majdnem, de nem pontosan az alkotó protonok, neutronok és elektronok tömegének összege. * Amikor a protonok, a neutronok és az elektronok atomot alkotnak, tömegük egy része energiává alakul és leadódik. (Ez az energiaforrás a magfúziós reakciókban.) Mivel az atom nem bontható fel alapvető részecskéire, hacsak a hiányzó tömeg energiáját kívülről nem látják el, ezt az energiát a mag kötési energiájának hívjuk. p>
Megjegyzés: Az atomtömeg és az atomtömeg
Az atomtömeg és a molekulatömeg kifejezéseket a dolgozó tudósok általánosan használják, és ebben a könyvben is használni fogják, noha ezek technikailag tömegek helyett súlyok.
| elektronok | protonok | neutronok |
Atomic Szám |
Atomsúly (amu) |
Teljes töltés (elektronegységek) |
|
|---|---|---|---|---|---|---|
| Hidrogénatom, 1H vagy H | 1 | 1 | 0 | 1 | 1.008 | 0 |
| Deutérium atom, 2H vagy D | 1 | 1 | 1 | 1 | 2.014 | 0 |
| Tritiumatom, 3H vagy T | 1 | 1 | 2 | 1 | 3.016 | 0 |
| Hidrogénion, H + | 0 | 1 | 0 | 1 | 1.007 | +1 |
| héliumatom, 4He | 2 | 2 | 2 | 2 | 4.003 | 0 |
| héliummag vagy alfa részecske, He2 + ill. α | 0 | 2 | 2 | 2 | 4.002 | +2 |
| Lítium atom, 7Li | 3 | 3 | 4 | 3 | 7.016 | 0 |
| Szénatom, 12Ca | 6 | 6 | 6 | 6 | 12.000 | 0 |
| Oxigénatom, 16O | 8 | 8 | 8 | 8 | 15.995 | 0 |
| Klóratom, 35Cl | 17 | 17 | 18 | 17 | 34.969 | 0 |
| Klóratom, 37Cl | 17 | 17 | 20 | 17 | 36.966 | 0 |
| Klór természetes keveréke | 17 | 17 | 18 vagy 20 | 17 | 35.453 | 0 |
| Uránatom, 234U | 92 | 92 | 142 | 92 | 234.04 | 0 |
| uránatom, 235U | 92 | 92 | 143 | 92 | 235.04 | 0 |
| Uránatom, 238U | 92 | 92 | 146 | 92 | 238,05 | 0 |
| Az urán természetes keveréke | 92 | 92 | változatos | 92 | 238.03 | 0 |
1.2. Példa. 2
Számítsa ki azt a tömeget, amely elveszik, amikor a 12-es szénatom protonokból, elektronokból és neutronokból képződik.
Megoldás
Mivel az atom Minden szénatom mber értéke 6, a 12-es szénatomnak 6 protonja van, ezért 6 elektronja van. A neutronok számának meghatározásához kivonjuk a protonok számát a tömegszámból: 12 – 6 = 6 neutron. Az 1-1. Táblázat adatait felhasználva kiszámíthatjuk ezen részecskék teljes tömegét:
| Protonok: | 6 X 1.00728 amu = 6.04368 amu |
| Neutronok: | 6 X 1,00867 amu = 6,05202 amu |
| Elektronok: | 6 X 0.00055 amu = 0.00330 amu |
| Teljes részecsketömeg: 12.09900 amu |
De az atomi tömegegységek skálájának meghatározása szerint egy szén-12 atom tömege pontosan 12 amu. Ezért 0,0990 amu tömeg eltűnt az atom részecskéiből történő felépítése során.
1.2.3. Példa
Számítsa ki az atom várható atomtömegét klór izotópja, amelynek 20 neutronja van. Hasonlítsa össze ezt az izotóp tényleges atomtömegével az 1-2. Táblázat szerint.
Megoldás
A klórizotópnak 17 protonja és 20 neutronja van:
| Protonok: | 17 X 1,00728 amu = | 17.1238 amu |
| Semlegesek: | 20 X 1.00867 amu = | 20.1734 amu |
| Elektronok: | 17 X 0,00055 amu = | 0,0094 amu |
| Teljes részecsketömeg: | 37.3066 amu | |
| Tényleges megfigyelt atomsúly: | 36.966 amu | |
| Tömeg veszteség: | 0,341 amu |
Egy elem minden izotópjára jellemző az atomszám (a protonok teljes száma), a tömegszám (a protonok teljes száma) s és neutronok), valamint egy atomtömeg (atomtömeg atomtömeg-egységben). Mivel az atom keletkezésénél a tömegveszteség kicsi, a tömegszám általában megegyezik az atom tömegével a legközelebbi egész számra kerekítve. (Például a klór-37 atomtömege 36,966, amelyet 37-re kerekítenek.) Ha a természetben egy elemnek több izotópja van, akkor természetesen a kísérletileg megfigyelt atomtömeg (a természetes atomtömeg) lesz a súlyozott. az izotóp súlyok átlaga. Az átlagot az izotópok százalékos bősége szerint súlyozzuk. A klór a természetben 75,53% klór-35 (34,97 amu) és 24,47% klór-37 (36,97 amu) formájában fordul elő, így az izotóp súlyának súlyozott átlaga
\
a könyv hátsó borítójában megadott atomtömegek a természetben előforduló izotópok súlyozott átlagai, és ezeket az ábrákat fogjuk használni a továbbiakban, hacsak nem külön-külön egy izotópról tárgyalunk. Egy elem összes izotópja többnyire kémiailag ugyanúgy viselkedik. Viselkedésük eltér a tömegérzékeny tulajdonságok, például a diffúziós sebesség tekintetében, amelyeket később ebben a könyvben megvizsgálunk.
1.2.4. Példa
Magnézium ( Mg) három jelentős természetes izotóppal rendelkezik: az összes magnéziumatom 78,70% -ának atomtömege 23,985 amu, 10,13% -ának atomtömege 24,986 amu, és 11,17% -ának atomtömege 25,983 amu. Hány proton és neutron van jelen mindhárom izotópban? Hogyan írjuk fel az egyes izotópok szimbólumait? Végül, mekkora az atomtömegek súlyozott átlaga?
Megoldás
Összesen 12 proton van magnézium-izotópok. Az az izotóp, amelynek atomtömege 23,985 amu, tömegszáma 24 (protonok és neutronok), így a 24-12 proton 12 neutronot ad. Ennek az izotópnak a szimbóluma 24Mg. Hasonlóképpen, az izotóp, amelynek atomtömege 24.A 986 amu tömegszáma 25, 13 neutron és 25Mg szimbólumként. A harmadik izotóp (25,983 amu) tömegszáma 26, 14 neutron és 26Mg szimbólumként. Az átlagos atomsúlyt az alábbiak szerint számoljuk ki: >
A bórnak két természetben előforduló izotópja van, a lOB és a 11B. Tudjuk, hogy atomjainak 80,22% -a 11B, atomtömege 11,009 amu. Számítsa ki a hátsó borító belső oldalán megadott természetes atomtömegből a lOB izotóp atomtömegét.
Megoldás
Ha az összes bóratom 80,22% -a 11B, akkor 100,00 – 80,22 vagy 19,78% az ismeretlen izotóp. A W segítségével számíthatjuk az ismeretlen atomtömeget a számításunkba:
(0,8022 X 11,009) + (0,1978 XW) = 10,81 amu (természetes atomtömeg) W =  = 10.01 amu
= 10.01 amu
Közreműködők és hozzárendelések
-
R. E. Dickerson, HB Gray és Jr. Haight. A tartalmat a “Chemical Principles” -ből, az Általános Kémia főiskolai szintű bevezető szövegéből a Caltech könyvtár és Harry B. Gray engedélyével a szerzők nevében használták. / p>
