원소의 모든 원자는 동일한 수의 양성자를 갖지만 원자가 가진 중성자의 수는 다를 수 있습니다 (표 1-2). 같은 원소의 서로 다른 원자를 동위 원소라고합니다. 헬륨 (He)의 4 개의 동위 원소가 그림 1-1에 나와 있습니다. 염소 (Cl)의 모든 원자에는 17 개의 양성자가 있지만 15 ~ 23 개의 중성자를 가진 염소 동위 원소가 있습니다. 2 개의 염소 동위 원소 만이 자연에 존재하는데, 18 개의 중성자를 가진 것 (자연에서 발견되는 모든 염소 원자의 75.53 %)과 20 개의 중성자를 가진 것 (24.47 %)이 있습니다. 동위 원소 기호를 쓰려면 원자 번호를 아래 첨자로, 질량 번호 (양성자 + 중성자)를 위첨자로 원자 기호 왼쪽에 배치합니다. 자연적으로 발생하는 두 염소 동위 원소의 기호는  Cl 및
Cl 및 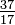 Cl입니다. 엄밀히 말하면 아래 첨자는 필요하지 않습니다. 염소의 모든 원자는 17 개의 양성자를 가지고 있기 때문입니다. 따라서 동위 원소 기호는 일반적으로 35Cl 및 37Cl과 같이 아래 첨자없이 작성됩니다. 이 동위 원소를 논의 할 때 우리는 사용합니다. 용어 chlorine-35 및 chlorine-37. 핵이 안정 되려면 중성자 수가 (처음 몇 가지 요소에 대해) 양성자 수와 같거나 약간 초과해야합니다. 양성자가 많을수록 안정성을 보장하기 위해 중성자와 양성자의 비율이 커집니다. 두 종류의 기본 입자가 너무 많은 핵은 불안정하며 23 장에서 논의 된 방식으로 방사능으로 분해됩니다.
Cl입니다. 엄밀히 말하면 아래 첨자는 필요하지 않습니다. 염소의 모든 원자는 17 개의 양성자를 가지고 있기 때문입니다. 따라서 동위 원소 기호는 일반적으로 35Cl 및 37Cl과 같이 아래 첨자없이 작성됩니다. 이 동위 원소를 논의 할 때 우리는 사용합니다. 용어 chlorine-35 및 chlorine-37. 핵이 안정 되려면 중성자 수가 (처음 몇 가지 요소에 대해) 양성자 수와 같거나 약간 초과해야합니다. 양성자가 많을수록 안정성을 보장하기 위해 중성자와 양성자의 비율이 커집니다. 두 종류의 기본 입자가 너무 많은 핵은 불안정하며 23 장에서 논의 된 방식으로 방사능으로 분해됩니다.

예 1.2.1
몇 개의 양성자, 중성자 및 전자가 안에 있는지 가장 안정한 우라늄 동위 원소 인 우라늄 -238? 이 동위 원소에 대한 기호를 쓰십시오. 그림을 참조하십시오. 1-1.
Solution
우라늄의 원자 번호 (뒷 표지 안쪽 참조)는 92이고 동위 원소의 질량수는 238입니다. 따라서 그것은 92입니다. 양성자, 92 개의 전자, 238-92 = 146 개의 중성자. 그 기호는  U (또는 238U)입니다.
U (또는 238U)입니다.
원자의 총 질량을 원자량이라고하며 이것은 거의 그렇지 않습니다. 구성하는 양성자, 중성자 및 전자의 질량의 합계입니다. * 양성자, 중성자 및 전자가 결합하여 원자를 형성하면 질량의 일부가 에너지로 변환되어 방출됩니다. (이것이 핵융합 반응의 에너지 원입니다.) 손실 된 질량에 대한 에너지가 외부에서 공급되지 않으면 원자가 기본 입자로 분해 될 수 없기 때문에이 에너지를 핵의 결합 에너지라고합니다.
참고 : 원자량 대 원자량
원자량과 분자량이라는 용어는 일하는 과학자들이 보편적으로 사용하며 기술적으로는이 책에서 사용될 것입니다. 무게보다는 질량.
| 전자 | 양성자 | 중성자 |
원자 숫자 |
원자량 (amu) |
총 충전 (전자 단위) |
|
|---|---|---|---|---|---|---|
| 수소 원자, 1H 또는 H | 1 | 1 | 0 | 1 | 1.008 | 0 |
| 중수소 원자, 2H 또는 D | 1 | 1 | 1 | 1 | 2.014 | 0 |
| 트리튬 원자, 3H 또는 T | 1 | 1 | 2 | 1 | 3.016 | 0 |
| 수소 이온, H + | 0 | 1 | 0 | 1 | 1.007 | +1 |
| 헬륨 원자, 4He | 2 | 2 | 2 | 2 | 4.003 | 0 |
| 헬륨 핵 또는 알파 입자, He2 + 또는 α | 0 | 2 | 2 | 2 | 4.002 | +2 |
| 리튬 원자, 7Li | 3 | 3 | 4 | 3 | 7.016 | 0 |
| 탄소 원자, 12Ca | 6 | 6 | 6 | 6 | 12.000 | 0 |
| 산소 원자, 16O | 8 | 8 | 8 | 8 | 15.995 | 0 |
| 염소 원자, 35Cl | 17 | 17 | 18 | 17 | 34.969 | 0 |
| 염소 원자, 37Cl | 17 | 17 | 20 | 17 | 36.966 | 0 |
| 자연 발생 염소 혼합물 | 17 | 17 | 18 또는 20 | 17 | 35.453 | 0 |
| 우라늄 원자, 234U | 92 | 92 | 142 | 92 | 234.04 | 0 |
| 우라늄 원자, 235U | 92 | 92 | 143 | 92 | 235.04 | 0 |
| 우라늄 원자, 238U | 92 | 92 | 146 | 92 | 238.05 | 0 |
| 자연적으로 발생하는 우라늄 혼합물 | 92 | 92 | 가변 | 92 | 238.03 | 0 |
예 1.2. 2
양성자, 전자, 중성자로부터 탄소 -12 원자가 형성 될 때 손실되는 질량을 계산합니다.
해결책
원자력 이후 모든 탄소 원자의 mber는 6이고, 탄소 -12에는 6 개의 양성자가 있으므로 6 개의 전자가 있습니다. 중성자의 수를 찾기 위해 질량 수에서 양성자 수를 뺍니다 : 12-6 = 6 중성자. 표 1-1의 데이터를 사용하여 이러한 입자의 총 질량을 계산할 수 있습니다.
| 양성자 : | 6 X 1.00728 amu = 6.04368 amu |
| 중성자 : | 6 X 1.00867 amu = 6.05202 amu |
| 전자 : | 6 X 0.00055 amu = 0.00330 amu |
| 총 입자 질량 : 12.09900 amu |
하지만 원자 질량 단위의 정의에 따르면 탄소 -12 원자 하나의 질량은 정확히 12입니다. amu. 따라서 입자에서 원자를 만드는 과정에서 0.0990 amu의 질량이 사라졌습니다.
예 1.2.3
예상 원자량 계산 20 개의 중성자를 가진 염소의 동위 원소. 이것을 표 1-2에 제시된이 동위 원소의 실제 원자량과 비교하십시오.
해결 방법
염소 동위 원소에는 17 개의 양성자와 20 개의 중성자가 있습니다.
| 양성자 : | 17 X 1.00728 amu = | 17.1238 amu |
| 중성자 : | 20 X 1.00867 amu = | 20.1734 amu |
| 전자 : | 17 X 0.00055 amu = | 0.0094 amu |
| 총 입자 질량 : | 37.3066 amu | |
| 실제 관측 원자량 : | 36.966 amu | |
| 대량 손실 : | 0.341amu |
원소의 각 동위 원소는 원자 번호 (총 양성자 수), 질량 수 (총 양성자 수 s 및 중성자) 및 원자량 (원자 질량 단위의 원자 질량). 원자 형성시 질량 손실이 적기 때문에 질량 수는 일반적으로 가장 가까운 정수로 반올림 된 원자량과 동일합니다. (예를 들어, chlorine-37의 원자량은 36.966이며, 이는 37로 반올림됩니다.) 자연에 원소의 동위 원소가 여러 개 있다면 물론 실험적으로 관찰 된 원자량 (자연 원자량)이 가중치가됩니다. 동위 원소 무게의 평균. 평균은 동위 원소의 존재 비율에 따라 가중됩니다. 염소는 자연에서 75.53 % chlorine-35 (34.97 amu)와 24.47 % chlorine-37 (36.97 amu)으로 발생하므로 동위 원소 무게의 가중 평균은 다음과 같습니다.
\
이 책의 뒷 표지에 제시된 원자량은 모두 자연에서 발생하는 동위 원소의 가중 평균값이며, 이것은 우리가 한 동위 원소에 대해 구체적으로 논의하지 않는 한 이후에 사용할 수치입니다. 원소의 모든 동위 원소는 대부분 화학적으로 동일한 방식으로 행동합니다. 이 책의 뒷부분에서 살펴볼 확산 속도와 같은 질량에 민감한 특성과 관련하여 이들의 동작이 다릅니다.
예 1.2.4
마그네슘 ( Mg)에는 세 가지 중요한 천연 동위 원소가 있습니다. 모든 마그네슘 원자의 78.70 %는 원자량 23.985amu, 10.13 %는 원자량 24.986amu, 11.17 %는 원자량 25.983amu를가집니다. 양성자와 중성자는 몇 개입니까? 이 세 개의 동위 원소 각각에 있습니까? 각 동위 원소에 대한 기호는 어떻게 작성합니까? 마지막으로 원자 무게의 가중 평균은 얼마입니까?
해결책
모두 12 개의 양성자가 있습니다. 마그네슘 동위 원소. 원자량이 23.985 amu 인 동위 원소는 질량수가 24 (양성자와 중성자)이므로 24-12 개의 양성자는 12 개의 중성자를 제공합니다.이 동위 원소의 기호는 24Mg입니다. 마찬가지로 원자량이 24 인 동위 원소입니다.986 amu는 25, 13 중성자, 25Mg의 질량을 상징으로 가지고 있습니다. 세 번째 동위 원소 (25.983amu)는 질량수가 26 개, 중성자 14 개, 기호로 26Mg입니다. 평균 원자량은 다음과 같이 계산됩니다.
(0.7870 X 23.985) + (0.1013 X 24.986) + (0.1117 X 25.983) = 24.31 amu
예 1.2.5
붕소에는 자연적으로 발생하는 두 개의 동위 원소 인 10B와 11B가 있습니다. 우리는 원자의 80.22 %가 11B, 원자량 11.009 amu라는 것을 알고 있습니다. 뒷면 표지 안쪽에 표시된 자연 원자량에서 10B 동위 원소의 원자량을 계산합니다.
해결책
모든 붕소 원자의 80.22 %가 11B이면 100.00-80.22 , 또는 19.78 %는 알려지지 않은 동위 원소입니다. W를 사용하여 계산에서 알 수없는 원자량을 나타낼 수 있습니다.
(0.8022 X 11.009) + (0.1978 XW) = 10.81 amu (자연 원자량) W =  = 10.01 amu
= 10.01 amu
참여자 및 기여
-
R. E. Dickerson, HB Gray 및 GP Haight, Jr. 콘텐츠는 저자를 대신하여 Caltech 도서관과 Harry B. Gray의 허가를 받아 일반 화학에 대한 대학 수준의 입문 텍스트 인 “Chemical Principles”에서 사용되었습니다.
