Chociaż wszystkie atomy pierwiastka mają taką samą liczbę protonów, atomy mogą różnić się liczbą neutronów, które mają (Tabela 1-2). Te różne atomy tego samego pierwiastka nazywane są izotopami. Cztery izotopy helu (He) pokazano na rysunku 1-1. Wszystkie atomy chloru (Cl) mają 17 protonów, ale są izotopy chloru mające od 15 do 23 neutronów. W przyrodzie występują tylko dwa izotopy chloru w znaczących ilościach, te zawierające 18 neutronów (75,53% wszystkich atomów chloru występujących w przyrodzie) i te z 20 neutronami (24,47%). Aby napisać symbol izotopu, umieść liczbę atomową jako indeks dolny, a liczbę masową (protony plus neutrony) jako indeks górny po lewej stronie symbolu atomowego. Symbolami dwóch naturalnie występujących izotopów chloru byłyby wówczas  Cl i
Cl i 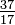 Cl. Ściśle mówiąc, indeks dolny jest niepotrzebny, ponieważ wszystkie atomy chloru mają 17 protonów. Stąd symbole izotopów są zwykle zapisywane bez indeksu dolnego: 35Cl i 37Cl. Omawiając te izotopy, używamy. określają chlor-35 i chlor-37. Aby jądro było stabilne, liczba neutronów powinna (dla kilku pierwszych pierwiastków) być równa lub nieznacznie większa od liczby protonów. Im więcej protonów, tym większy stosunek neutronów do protonów zapewniający stabilność. Jądra, które mają zbyt wiele cząstek podstawowych któregokolwiek rodzaju, są niestabilne i rozpadają się radioaktywnie w sposób omówiony w rozdziale 23.
Cl. Ściśle mówiąc, indeks dolny jest niepotrzebny, ponieważ wszystkie atomy chloru mają 17 protonów. Stąd symbole izotopów są zwykle zapisywane bez indeksu dolnego: 35Cl i 37Cl. Omawiając te izotopy, używamy. określają chlor-35 i chlor-37. Aby jądro było stabilne, liczba neutronów powinna (dla kilku pierwszych pierwiastków) być równa lub nieznacznie większa od liczby protonów. Im więcej protonów, tym większy stosunek neutronów do protonów zapewniający stabilność. Jądra, które mają zbyt wiele cząstek podstawowych któregokolwiek rodzaju, są niestabilne i rozpadają się radioaktywnie w sposób omówiony w rozdziale 23.

Przykład 1.2.1
Ile protonów, neutronów i elektronów znajduje się w atom najbardziej stabilnego izotopu uranu, uranu-238? Napisz symbol tego izotopu. Patrz rysunek. 1-1.
Rozwiązanie
Liczba atomowa uranu (patrz wewnętrzna strona tylnej okładki) wynosi 92, a liczba masowa izotopu jest podana jako 238. W związku z tym ma 92 protony, 92 elektrony i 238 – 92 = 146 neutronów. Jego symbol to  U (lub 238U).
U (lub 238U).
Całkowita masa atomu jest nazywana jego masą atomową i jest to prawie, ale nie dokładnie suma mas składowych protonów, neutronów i elektronów. * Kiedy protony, neutrony i elektrony łączą się, tworząc atom, część ich masy jest przekształcana w energię i jest uwalniana. (Jest to źródło energii w reakcjach fuzji jądrowej). Ponieważ atom nie może zostać rozbity na jego podstawowe cząstki, chyba że energia brakującej masy jest dostarczana z zewnątrz, energia ta nazywana jest energią wiązania jądra.
Uwaga: masa atomowa a masa atomowa
Terminy masa atomowa i masa cząsteczkowa są powszechnie używane przez pracujących naukowców i będą używane w tej książce, mimo że są technicznie masy zamiast ciężarów.
| Elektrony | Protony | Neutrony |
Atomowa Liczba |
Masa atomowa (amu) |
Łączna opłata (jednostki elektronowe) |
|
|---|---|---|---|---|---|---|
| Atom wodoru, 1H lub H | 1 | 1 | 0 | 1 | 1,008 | 0 |
| Atom deuteru, 2H lub D | 1 | 1 | 1 | 1 | 2.014 | 0 |
| Atom trytu, 3H lub T | 1 | 1 | 2 | 1 | 3.016 | 0 |
| Jon wodoru, H + | 0 | 1 | 0 | 1 | 1,007 | +1 |
| Atom helu, 4He | 2 | 2 | 2 | 2 | 4,003 | 0 |
| Jądro helu lub cząstka alfa, He2 + lub α | 0 | 2 | 2 | 2 | 4,002 | +2 |
| Atom litu, 7Li | 3 | 3 | 4 | 3 | 7,016 | 0 |
| Atom węgla, 12Ca | 6 | 6 | 6 | 6 | 12.000 | 0 |
| Atom tlenu, 16O | 8 | 8 | 8 | 8 | 15.995 | 0 |
| Atom chloru, 35Cl | 17 | 17 | 18 | 17 | 34.969 | 0 |
| Atom chloru, 37Cl | 17 | 17 | 20 | 17 | 36.966 | 0 |
| Naturalnie występująca mieszanina chloru | 17 | 17 | 18 lub 20 | 17 | 35,453 | 0 |
| Atom uranu, 234U | 92 | 92 | 142 | 92 | 234,04 | 0 |
| Atom uranu, 235U | 92 | 92 | 143 | 92 | 235,04 | 0 |
| Atom uranu, 238U | 92 | 92 | 146 | 92 | 238,05 | 0 |
| Naturalnie występująca mieszanina uranu | 92 | 92 | zróżnicowane | 92 | 238.03 | 0 |
Przykład 1.2. 2
Oblicz masę, która jest tracona, gdy atom węgla-12 powstaje z protonów, elektronów i neutronów.
Rozwiązanie
Ponieważ atomowy nu mber każdego atomu węgla to 6, węgiel-12 ma 6 protonów, a zatem 6 elektronów. Aby znaleźć liczbę neutronów, odejmujemy liczbę protonów od liczby masowej: 12 – 6 = 6 neutronów. Możemy wykorzystać dane w tabeli 1-1 do obliczenia całkowitej masy tych cząstek:
| Protony: | 6 X 1,00728 amu = 6,04368 amu |
| Neutrony: | 6 X 1,00867 amu = 6.05202 amu |
| Elektrony: | 6 X 0.00055 amu = 0,00330 amu |
| Całkowita masa cząstek: 12,09900 amu |
Jednak zgodnie z definicją skali jednostek masy atomowej masa jednego atomu węgla-12 wynosi dokładnie 12 amu. Stąd 0,0990 amu masy zniknęło w procesie budowania atomu z jego cząstek.
Przykład 1.2.3
Oblicz spodziewaną masę atomową izotop chloru, który ma 20 neutronów. Porównaj to z rzeczywistą masą atomową tego izotopu podaną w tabeli 1-2.
Rozwiązanie
Izotop chloru ma 17 protonów i 20 neutronów:
| Protony: | 17 X 1,00728 amu = | 17.1238 amu |
| Neutrony: | 20 X 1,00867 amu = | 20,1734 amu |
| Elektrony: | 17 X 0.00055 amu = | 0,0094 amu |
| Całkowita masa cząstek: | 37.3066 amu | |
| Rzeczywista obserwowana masa atomowa: | 36,966 amu | |
| Utrata masy: | 0,341 amu |
Każdy izotop pierwiastka jest scharakteryzowany przez liczbę atomową (całkowitą liczbę protonów), liczbę masową (całkowitą liczbę protonów si neutrony) oraz masę atomową (masa atomu w atomowych jednostkach masy). Ponieważ straty masy podczas tworzenia atomu są małe, liczba masowa jest zwykle taka sama jak masa atomowa zaokrąglona do najbliższej liczby całkowitej. (Na przykład masa atomowa chloru-37 wynosi 36,966, co zaokrągla się do 37.) Jeśli w naturze występuje kilka izotopów pierwiastka, to oczywiście obserwowana eksperymentalnie masa atomowa (naturalna masa atomowa) będzie wagą ważoną średnią mas izotopów. Średnia jest ważona zgodnie z procentową zawartością izotopów. Chlor występuje w naturze jako 75,53% chloru-35 (34,97 amu) i 24,47% chloru-37 (36,97 amu), więc średnia ważona mas izotopów wynosi
\
masy atomowe podane na tylnej okładce tej książki to wszystkie średnie ważone izotopów występujących w przyrodzie i są to liczby, których będziemy używać odtąd – chyba że omawiamy konkretnie jeden izotop. Wszystkie izotopy pierwiastka zachowują się w większości w ten sam sposób chemicznie. Ich zachowanie będzie się różnić w zależności od właściwości wrażliwych na masę, takich jak szybkości dyfuzji, którym przyjrzymy się w dalszej części tej książki.
Przykład 1.2.4
Magnez ( Mg) ma trzy istotne naturalne izotopy: 78,70% wszystkich atomów magnezu ma masę atomową 23,985 amu, 10,13% ma masę atomową 24,986 amu, a 11,17% ma masę atomową 25,983 amu. Ile obecnych jest protonów i neutronów w każdym z tych trzech izotopów? Jak zapisujemy symbole dla każdego izotopu? Na koniec, jaka jest średnia ważona mas atomowych?
Rozwiązanie
W sumie jest 12 protonów izotopy magnezu. Izotop o masie atomowej 23,985 amu ma liczbę masową 24 (protony i neutrony), więc 24-12 protonów daje 12 neutronów. Symbol tego izotopu to 24Mg. Podobnie izotop o masie atomowej 24.986 amu ma liczbę masową 25, 13 neutronów i 25Mg jako symbol. Trzeci izotop (25,983 amu) ma liczbę masową 26, 14 neutronów i 26Mg jako symbol. Obliczamy średnią masę atomową w następujący sposób:
(0,7870 X 23,985) + (0,1013 X 24,986) + (0,1117 X 25,983) = 24,31 amu
Przykład 1.2.5
Bor ma dwa naturalnie występujące izotopy, lOB i 11B. Wiemy, że 80,22% jego atomów to 11B, masa atomowa 11,009 amu. Z naturalnej masy atomowej podanej na wewnętrznej stronie tylnej okładki obliczyć masę atomową izotopu LOB.
Rozwiązanie
Jeśli 80,22% wszystkich atomów boru ma wielkość 11B, to 100,00 – 80,22 lub 19,78% to nieznany izotop. W naszych obliczeniach możemy użyć W do przedstawienia nieznanej masy atomowej:
(0,8022 X 11,009) + (0,1978 XW) = 10,81 amu (naturalna masa atomowa) W =  = 10.01 amu
= 10.01 amu
Współtwórcy i składki
-
R. E. Dickerson, HB Gray i GP Haight, Jr. Treść została wykorzystana z „Chemical Principles”, wstępnego tekstu z zakresu chemii ogólnej na poziomie college’u, za zgodą biblioteki Caltech i Harry’ego B. Graya w imieniu autorów.
