Ačkoli všechny atomy prvku mají stejný počet protonů, atomy se mohou lišit v počtu neutronů, které mají (tabulka 1-2). Tyto odlišné atomy stejného prvku se nazývají izotopy. Čtyři izotopy helia (He) jsou znázorněny na obrázku 1-1. Všechny atomy chloru (Cl) mají 17 protonů, ale existují izotopy chloru s 15 až 23 neutrony. V přírodě existují pouze dva izotopy chloru ve významných množstvích, ty s 18 neutrony (75,53% všech atomů chloru nalezených v přírodě) a ty s 20 neutrony (24,47%). Chcete-li napsat symbol pro izotop, umístěte atomové číslo jako dolní index a hmotnostní číslo (protony plus neutrony) jako horní index nalevo od atomového symbolu. Symboly pro dva přirozeně se vyskytující izotopy chloru by pak byly  Cl a
Cl a 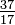 Cl. Přesně řečeno, dolní index je zbytečný, protože všechny atomy chloru mají 17 protonů. Proto jsou izotopové symboly obvykle psány bez dolního indexu: 35Cl a 37Cl. Při diskusi o těchto izotopech používáme. pojmy chlor-35 a chlor-37. Aby bylo jádro stabilní, měl by se počet neutronů (pro prvních pár prvků) rovnat nebo mírně přesahovat počet protonů. Čím více protonů, tím větší je poměr neutronů k protonům, aby byla zajištěna stabilita. Jádra, která mají příliš mnoho obou druhů základních částic, jsou nestabilní a radioaktivně se rozpadají způsoby, které jsou popsány v kapitole 23.
Cl. Přesně řečeno, dolní index je zbytečný, protože všechny atomy chloru mají 17 protonů. Proto jsou izotopové symboly obvykle psány bez dolního indexu: 35Cl a 37Cl. Při diskusi o těchto izotopech používáme. pojmy chlor-35 a chlor-37. Aby bylo jádro stabilní, měl by se počet neutronů (pro prvních pár prvků) rovnat nebo mírně přesahovat počet protonů. Čím více protonů, tím větší je poměr neutronů k protonům, aby byla zajištěna stabilita. Jádra, která mají příliš mnoho obou druhů základních částic, jsou nestabilní a radioaktivně se rozpadají způsoby, které jsou popsány v kapitole 23.

Příklad 1.2.1
Kolik protonů, neutronů a elektronů je v atom nejstabilnějšího izotopu uranu, uran-238? Napište symbol pro tento izotop. Viz obrázek. 1-1.
Řešení
Atomové číslo uranu (viz vnitřní zadní strana obálky) je 92 a hmotnostní číslo izotopu je uvedeno jako 238. Proto má 92 protony, 92 elektronů a 238 – 92 = 146 neutronů. Jeho symbolem je  U (nebo 238U).
U (nebo 238U).
Celková hmotnost atomu se nazývá jeho atomová hmotnost, což je téměř, ale ne přesně součet hmot jeho základních protonů, neutronů a elektronů. * Když se protony, neutrony a elektrony spojí a vytvoří atom, část jejich hmoty se převede na energii a vydá se. (Toto je zdroj energie při reakcích jaderné fúze.) Protože atom nelze rozložit na jeho základní částice, pokud není dodána energie pro chybějící hmotu zvenčí, nazývá se tato energie vazebnou energií jádra.
Poznámka: Atomová hmotnost vs. atomová hmotnost
Termíny atomová hmotnost a molekulová hmotnost jsou běžně používány pracujícími vědci a budou použity v této knize, i když jsou technicky hmotnosti spíše než váhy.
| Elektrony | Protony | Neutrony |
Atomová Počet |
Atomová hmotnost (amu) |
Celková částka (elektronové jednotky) |
|
|---|---|---|---|---|---|---|
| atom vodíku, 1H nebo H | 1 | 1 | 0 | 1 | 1,008 | 0 |
| atom deuteria, 2H nebo D | 1 | 1 | 1 | 1 | 2.014 | 0 |
| atom tritia, 3H nebo T | 1 | 1 | 2 | 1 | 3.016 | 0 |
| vodíkový iont, H + | 0 | 1 | 0 | 1 | 1.007 | +1 |
| atom hélia, 4He | 2 | 2 | 2 | 2 | 4,003 | 0 |
| jádro hélia nebo alfa částice, He2 + nebo α | 0 | 2 | 2 | 2 | 4,002 | +2 |
| atom lithia, 7Li | 3 | 3 | 4 | 3 | 7,016 | 0 |
| atom uhlíku, 12Ca | 6 | 6 | 6 | 6 | 12.000 | 0 |
| Atom kyslíku, 16O | 8 | 8 | 8 | 8 | 15.995 | 0 |
| atom chloru, 35Cl | 17 | 17 | 18 | 17 | 34.969 | 0 |
| atom chloru, 37Cl | 17 | 17 | 20 | 17 | 36966 | 0 |
| přirozeně se vyskytující směs chloru | 17 | 17 | 18 nebo 20 | 17 | 35,453 | 0 |
| atom uranu, 234U | 92 | 92 | 142 | 92 | 234.04 | 0 |
| atom uranu, 235U | 92 | 92 | 143 | 92 | 235.04 | 0 |
| atom uranu, 238U | 92 | 92 | 146 | 92 | 238,05 | 0 |
| Přirozeně se vyskytující směs uranu | 92 | 92 | pestrá | 92 | 238.03 | 0 |
Příklad 1.2. 2
Vypočítejte hmotnost, která se ztratí, když je atom uhlíku-12 vytvořen z protonů, elektronů a neutronů.
Řešení
Protože atomový nu Hodnota každého atomu uhlíku je 6, uhlík-12 má 6 protonů a tedy 6 elektronů. Abychom zjistili počet neutronů, odečteme počet protonů od hmotnostního čísla: 12 – 6 = 6 neutronů. Údaje v tabulce 1-1 můžeme použít k výpočtu celkové hmotnosti těchto částic:
| Protony: | 6 X 1,00728 amu = 6.04368 amu |
| Neutrony: | 6 X 1,00867 amu = 6,05202 amu |
| Elektrony: | 6 X 0,00055 amu = 0,00330 amu |
| Celková hmotnost částic: 12,09900 amu |
Podle definice stupnice atomových hmotnostních jednotek je však hmotnost jednoho atomu uhlíku-12 přesně 12 amu. Proto v procesu budování atomu z jeho částic zmizelo 0,0990 amu hmoty.
Příklad 1.2.3
Vypočítejte očekávanou atomovou hmotnost izotop chloru, který má 20 neutronů. Porovnejte to se skutečnou atomovou hmotností tohoto izotopu, jak je uvedeno v tabulce 1-2.
Řešení
Izotop chloru má 17 protonů a 20 neutronů:
| Protony: | 17 X 1,00728 amu = | 17.1238 amu |
| Neutrony: | 20 X 1,00867 amu = | 20.1734 amu |
| elektrony: | 17 X 0,00055 amu = | 0,0094 amu |
| celková hmotnost částic: | 37,3066 amu | |
| Skutečná pozorovaná atomová hmotnost: | 36 966 amu | |
| hromadná ztráta: | 0,341 amu |
Každý izotop prvku je charakterizován atomovým číslem (celkový počet protonů), hromadným číslem (celkový počet protonů) s a neutrony) a atomová hmotnost (hmotnost atomu v jednotkách atomové hmotnosti). Vzhledem k tomu, že ztráty hmotnosti při tvorbě atomu jsou malé, je hmotnostní číslo obvykle stejné jako hmotnost atomu zaokrouhlená na nejbližší celé číslo. (Například atomová hmotnost chloru-37 je 36 966, což je zaokrouhleno na 37.) Pokud existuje v přírodě několik izotopů prvku, pak bude samozřejmě experimentálně pozorovaná atomová hmotnost (přirozená atomová hmotnost) vážená. průměr izotopových hmotností. Průměr je vážen podle procenta hojnosti izotopů. Chlór se v přírodě vyskytuje jako 75,53% chloru-35 (34,97 amu) a 24,47% chloru-37 (36,97 amu), takže vážený průměr hmotností izotopů je
\
atomové hmotnosti uvedené na zadní straně obálky této knihy jsou váženými průměry izotopů vyskytujících se v přírodě, a toto jsou údaje, které budeme od nynějška používat – pokud nebudeme konkrétně diskutovat o jednom izotopu. Všechny izotopy prvku se chovají z větší části stejně chemicky. Jejich chování se bude lišit, pokud jde o vlastnosti citlivé na hmotnost, jako jsou rychlosti difúze, na které se podíváme dále v této knize.
Příklad 1.2.4
Hořčík ( Mg) má tři významné přírodní izotopy: 78,70% všech atomů hořčíku má atomovou hmotnost 23,985 amu, 10,13% má atomovou hmotnost 24,986 amu a 11,17% má atomovou hmotnost 25,983 amu. Kolik protonů a neutronů je přítomno v každém z těchto tří izotopů? Jak píšeme symboly pro každý izotop? Nakonec, jaký je vážený průměr atomových hmotností?
Řešení
Ve všech je 12 protonů izotopy hořčíku. Izotop, jehož atomová hmotnost je 23,985 amu, má hmotnostní číslo 24 (protony a neutrony), takže 24-12 protonů dává 12 neutronů. Symbol tohoto izotopu je 24Mg. Podobně izotop, jehož atomová hmotnost je 24.986 amu má hromadné číslo 25, 13 neutronů a 25Mg jako symbol. Třetí izotop (25,983 amu) má hmotnostní číslo 26, 14 neutronů a 26Mg jako symbol. Průměrnou atomovou hmotnost vypočítáme následovně:
(0,7870 X 23,985) + (0,1013 X 24,986) + (0,1117 X 25,983) = 24,31 amu
Příklad 1.2.5
Bor má dva přirozeně se vyskytující izotopy, lOB a 11B. Víme, že 80,22% jeho atomů je 11B, atomová hmotnost 11,009 amu. Z přirozené atomové hmotnosti uvedené na vnitřní zadní straně obálky vypočítáme atomovou hmotnost izotopu lOB.
Řešení
Pokud 80,22% všech atomů boru je 11B, pak 100,00 – 80,22 , neboli 19,78%, je neznámý izotop. Můžeme použít W k vyjádření neznámé atomové hmotnosti v našem výpočtu:
(0,8022 X 11,009) + (0,1978 XW) = 10,81 amu (přirozená atomová hmotnost) W =  = 10.01 amu
= 10.01 amu
Přispěvatelé a uvedení
-
R. E. Dickerson, HB Gray a GP Haight, Jr. Obsah byl použit z „Chemical Principles“, úvodního textu na vysoké škole pro General Chemistry se svolením knihovny Caltech a Harry B. Graye jménem autorů.
