Deși toți atomii unui element au același număr de protoni, atomii pot diferi prin numărul de neutroni pe care îl au (Tabelul 1-2). Acești atomi diferiți ai aceluiași element se numesc izotopi. Patru izotopi de heliu (He) sunt prezentați în Figura 1-1. Toți atomii de clor (Cl) au 17 protoni, dar există izotopi de clor cu 15 până la 23 de neutroni. Există doar doi izotopi de clor în cantități semnificative în natură, cei cu 18 neutroni (75,53% din toți atomii de clor găsiți în natură) și cei cu 20 de neutroni (24,47%). Pentru a scrie simbolul unui izotop, plasați numărul atomic ca un indice și numărul de masă (protoni plus neutroni) ca un supercript în stânga simbolului atomic. Simbolurile pentru cei doi izotopi naturali ai clorului ar fi atunci  Cl și
Cl și 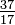 Cl. Strict vorbind, indicele nu este necesar, deoarece toți atomii de clor au 17 protoni. Prin urmare, simbolurile izotopului sunt de obicei scrise fără indicele: 35Cl și 37Cl. În discutarea acestor izotopi, folosim. termeni clor-35 și clor-37. Pentru ca un nucleu să fie stabil, numărul de neutroni ar trebui (pentru primele câteva elemente) să fie egal sau să depășească ușor numărul de protoni. Cu cât sunt mai mulți protoni, cu atât este mai mare raportul dintre neutroni și protoni pentru a asigura stabilitatea. Nucleii care au prea multe dintre ambele tipuri de particule fundamentale sunt instabile și se descompun radioactiv în moduri discutate în capitolul 23.
Cl. Strict vorbind, indicele nu este necesar, deoarece toți atomii de clor au 17 protoni. Prin urmare, simbolurile izotopului sunt de obicei scrise fără indicele: 35Cl și 37Cl. În discutarea acestor izotopi, folosim. termeni clor-35 și clor-37. Pentru ca un nucleu să fie stabil, numărul de neutroni ar trebui (pentru primele câteva elemente) să fie egal sau să depășească ușor numărul de protoni. Cu cât sunt mai mulți protoni, cu atât este mai mare raportul dintre neutroni și protoni pentru a asigura stabilitatea. Nucleii care au prea multe dintre ambele tipuri de particule fundamentale sunt instabile și se descompun radioactiv în moduri discutate în capitolul 23.

Exemplul 1.2.1
Câți protoni, neutroni și electroni sunt un atom al izotopului cel mai stabil al uraniului, uraniul-238? Scrieți simbolul acestui izotop. Consultați Figura. 1-1.
Soluție
Numărul atomic de uraniu (vezi capacul posterior interior) este 92, iar numărul de masă al izotopului este dat ca 238. Prin urmare, are 92 protoni, 92 de electroni și 238 – 92 = 146 de neutroni. Simbolul său este  U (sau 238U).
U (sau 238U).
Masa totală a unui atom se numește greutatea sa atomică și aceasta este aproape, dar nu exact suma masei protonilor, neutronilor și electronilor săi constituenți. * Când protoni, neutroni și electroni se combină pentru a forma un atom, o parte din masa lor este convertită în energie și se degajă. (Aceasta este sursa de energie în reacțiile de fuziune nucleară.) Deoarece atomul nu poate fi descompus în particulele sale fundamentale decât dacă energia pentru masa lipsă este furnizată din afara acestuia, această energie se numește energia de legare a nucleului.
Notă: Greutatea atomică față de masa atomică
Termenii greutate atomică și greutate moleculară sunt folosiți universal de oamenii de știință care lucrează și vor fi folosiți în această carte, chiar dacă aceștia sunt tehnic masele mai degrabă decât greutățile.
| Electroni | Protoni | Neutroni |
Atomic Număr |
Greutate atomică (amu) |
Taxă totală (unități electronice) |
|
|---|---|---|---|---|---|---|
| Atom de hidrogen, 1H sau H | 1 | 1 | 0 | 1 | 1.008 | 0 |
| Atom de deuteriu, 2H sau D | 1 | 1 | 1 | 1 | 2.014 | 0 |
| Atom de tritiu, 3H sau T | 1 | 1 | 2 | 1 | 3.016 | 0 |
| Ion hidrogen, H + | 0 | 1 | 0 | 1 | 1.007 | +1 |
| Atom de heliu, 4He | 2 | 2 | 2 | 2 | 4.003 | 0 |
| Nucleul de heliu sau particula alfa, He2 + sau α | 0 | 2 | 2 | 2 | 4.002 | +2 |
| Atom de litiu, 7Li | 3 | 3 | 4 | 3 | 7.016 | 0 |
| Atom de carbon, 12Ca | 6 | 6 | 6 | 6 | 12.000 | 0 |
| Atom de oxigen, 16O | 8 | 8 | 8 | 8 | 15.995 | 0 |
| Atom de clor, 35Cl | 17 | 17 | 18 | 17 | 34.969 | 0 |
| Atom de clor, 37Cl | 17 | 17 | 20 | 17 | 36.966 | 0 |
| Amestec natural de clor | 17 | 17 | 18 sau 20 | 17 | 35.453 | 0 |
| Atom de uraniu, 234U | 92 | 92 | 142 | 92 | 234.04 | 0 |
| Atom de uraniu, 235U | 92 | 92 | 143 | 92 | 235.04 | 0 |
| Atom de uraniu, 238U | 92 | 92 | 146 | 92 | 238.05 | 0 |
| Amestec natural de uraniu | 92 | 92 | variat | 92 | 238.03 | 0 |
Exemplul 1.2. 2
Calculați masa care se pierde atunci când un atom de carbon-12 este format din protoni, electroni și neutroni.
Soluție
Deoarece nu atomic mber din fiecare atom de carbon este de 6, carbon-12 are 6 protoni și deci 6 electroni. Pentru a găsi numărul de neutroni, scădem numărul de protoni din numărul de masă: 12 – 6 = 6 neutroni. Putem folosi datele din Tabelul 1-1 pentru a calcula masa totală a acestor particule:
| Protoni: | 6 X 1.00728 amu = 6.04368 amu |
| Neutroni: | 6 X 1.00867 amu = 6.05202 amu |
| Electroni: | 6 X 0.00055 amu = 0.00330 amu |
| Masa totală a particulelor: 12.09900 amu |
Dar prin definiția scalei unităților de masă atomică, masa unui atom de carbon-12 este exact 12 amu. Prin urmare, 0,0990 amu de masă au dispărut în procesul de construire a atomului din particulele sale.
Exemplul 1.2.3
Calculați greutatea atomică așteptată a izotop de clor care are 20 de neutroni. Comparați acest lucru cu greutatea atomică efectivă a acestui izotop, așa cum este dat în tabelul 1-2.
Soluție
Izotopul de clor are 17 protoni și 20 de neutroni:
| Protoni: | 17 X 1.00728 amu = | 17.1238 amu |
| Neutroni: | 20 X 1.00867 amu = | 20.1734 amu |
| Electroni: | 17 X 0.00055 amu = | 0.0094 amu |
| Masa totală a particulelor: | 37.3066 amu | |
| Greutatea atomică observată efectivă: | 36.966 amu | |
| Pierdere în masă: | 0.341 amu |
Fiecare izotop al unui element este caracterizat printr-un număr atomic (numărul total de protoni), un număr de masă (numărul total de protoni s și neutroni) și o greutate atomică (masa atomului în unități de masă atomică). Deoarece pierderile de masă la formarea unui atom sunt mici, numărul de masă este de obicei același cu greutatea atomică rotunjită la cel mai apropiat număr întreg. (De exemplu, greutatea atomică a clorului-37 este 36.966, care este rotunjită la 37.) Dacă există mai mulți izotopi ai unui element în natură, atunci, desigur, greutatea atomică observată experimental (greutatea atomică naturală) va fi ponderea media greutăților izotopului. Media este ponderată în funcție de abundența procentuală a izotopilor. Clorul apare în natură ca 75,53% clor-35 (34,97 amu) și 24,47% clor-37 (36,97 amu), deci media ponderată a greutăților izotopului este
\
greutățile atomice date în coperta din spate a acestei cărți sunt toate medii ponderate ale izotopilor care apar în natură și acestea sunt cifrele pe care le vom folosi de acum înainte – cu excepția cazului în care discutăm în mod specific un izotop. Toți izotopii unui element se comportă în același mod chimic în cea mai mare parte. Comportamentul lor va diferi în ceea ce privește proprietățile sensibile la masă, cum ar fi ratele de difuzie, pe care le vom analiza mai târziu în această carte.
Exemplul 1.2.4
Magneziu ( Mg) are trei izotopi naturali semnificativi: 78,70% din toți atomii de magneziu au o greutate atomică de 23,985 amu, 10,13% au o greutate atomică de 24,986 amu și 11,17% au o greutate atomică de 25,983 amu. Câți protoni și neutroni sunt prezenți în fiecare dintre acești trei izotopi? Cum scriem simbolurile pentru fiecare izotop? În cele din urmă, care este media ponderată a greutăților atomice?
Soluție
Există 12 protoni în total izotopi de magneziu. Izotopul a cărui greutate atomică este de 23985 amu are un număr de masă de 24 (protoni și neutroni), deci 24 – 12 protoni dau 12 neutroni. Simbolul acestui izotop este 24Mg. În mod similar, izotopul a cărui greutate atomică este 24986 amu are un număr de masă de 25, 13 neutroni și 25Mg ca simbol. Al treilea izotop (25.983 amu) are un număr de masă de 26, 14 neutroni și 26Mg ca simbol. Calculăm greutatea atomică medie după cum urmează:
(0.7870 X 23.985) + (0.1013 X 24.986) + (0.1117 X 25.983) = 24.31 amu
Exemplul 1.2.5
Borul are doi izotopi naturali, lOB și 11B. Știm că 80,22% din atomii săi sunt 11B, greutatea atomică 11,009 amu. Din greutatea atomică naturală dată pe capacul posterior interior, calculați greutatea atomică a izotopului lOB.
Soluție
Dacă 80,22% din toți atomii de bor sunt 11B, atunci 100,00 – 80,22 , sau 19,78%, sunt izotopul necunoscut. Putem folosi W pentru a reprezenta greutatea atomică necunoscută în calculul nostru:
(0.8022 X 11.009) + (0.1978 XW) = 10.81 amu (greutate atomică naturală) W =  = 10.01 amu
= 10.01 amu
Contribuitorii și atribuțiile
R. E. Dickerson, HB Gray și GP Haight, Jr. Conținutul a fost folosit din „Principiile chimice”, un text introductiv la nivel de colegiu pentru chimie generală cu permisiunea bibliotecii Caltech și a lui Harry B. Gray, în numele autorilor.
