Caso: Um homem de 73 anos com histórico de hipertensão, doença arterial coronariana e miocárdio prévio infarto (MI) se apresenta ao departamento de emergência (ED) com fadiga, falta de ar, diminuição da produção de urina e edema do tornozelo. Na chegada, seus sinais vitais incluem PA 87/58 mm Hg, FC 102, FR 24, saturação de T 86% em ar ambiente e temperatura de 98,2 F e ele apresenta estertores à ausculta. Como você trataria este paciente?
O que é choque cardiogênico?
Embora as definições variem, choque cardiogênico (CS) é um diagnóstico clínico amplamente definido como um estado de baixo débito cardíaco associado perfusão inadequada do órgão-alvo ou hipoperfusão tecidual secundária a dano cardíaco. 1 Os critérios comumente usados derivados do estudo SHOCK consistem em hipotensão (SBP < 90mmHg ou > 90mmHg com cuidados de suporte), evidência de hipoperfusão de órgãos e índice cardíaco (IC) < 2,2 L / min / m2 ou pressão capilar pulmonar ≥ 15 mmHg 2,3 Embora esta definição seja útil para padronizar os critérios de inclusão para ensaios clínicos , é menos valioso para o diagnóstico de SC no serviço de emergência (DE). No turno em um pronto-socorro movimentado, o diagnóstico de SC pode ser um desafio devido às diversas apresentações, sobreposição com outros estados de choque (por exemplo, sepse), fisiopatologia mal compreendida, causas complexas e multifatoriais e parâmetros hemodinâmicos variados.4 Na ausência de débito cardíaco invasivo (CO) e valores de PCWP, CS podem ser inferidos usando evidências de pressões de enchimento elevadas (ou seja, congestão pulmonar ou JVP elevada), sinais clínicos de hipoperfusão e uma história e eco sugestivos de insuficiência cardíaca. A mortalidade secundária à SC é alta (~ 25-70%), mas o reconhecimento e a intervenção precoces melhoram a sobrevida.4,5 Os médicos de emergência têm a oportunidade de diagnosticar a SC na admissão e devem manter uma alta suspeita clínica ao atender qualquer paciente gravemente enfermo. Esta revisão se concentrará no reconhecimento e dicas sobre como não perder o diagnóstico de SC por meio de exames físicos, laboratórios, ultrassom de cabeceira e imagens.
Quais são as causas do choque cardiogênico?
A maioria dos estudos de SC enfoca pacientes com SC secundária a infartos do miocárdio (IMs) envolvendo o ventrículo esquerdo. Embora MIs sejam a principal causa de CS (~ 70%), qualquer causa de disfunção ventricular e redução de CO ou índice cardíaco (CO / área de superfície corporal) como causa potencial deve ser considerada.6 Isso inclui, mas não está limitado a, causas não isquêmicas de insuficiência cardíaca direita, miocardite, cardiomiopatia de takotsubo, cardiomiopatia hipertrófica ou doença cardíaca valvar (Tabela 1). Para tornar as coisas mais desafiadoras, a SC é um continuum em vez de um estado estático, variando do agravamento da insuficiência cardíaca ao choque refratário com lesão irreversível de órgão-alvo (Figura 1). A SC torna-se ainda mais variável com a ocorrência de insultos secundários, como arritmias ou isquemia e acidose progressiva.3 Deve-se notar que em 2/3 dos casos, a SC não está presente na admissão, mas se desenvolve posteriormente nas 48 horas da internação como paciente progride no continuum do choque.7 É importante reavaliar frequentemente os sinais vitais dos pacientes, sintomas, exame físico e eco ao lado do leito.

Tabela 1: Causas de CS, adaptado de Parrillo & Dellinger (2013) .8 70% dos casos de CS são causados por MIs agudos.6 Efeitos de MI agudo com associados percentagens retiradas dos resultados do registro do ensaio SHOCK.9.10
Figura 1: Continuum de CS, adaptado de Bellumkonda et al . (2018) .3 Este espectro pode se desviar com insultos secundários (ex. Novas arritmias).
Mortalidade em choque cardiogênico
Embora a mortalidade secundária a CS permaneça alta, 4 reconhecimento e intervenção precoce melhora a sobrevida.5 Usando dados que incluíram o registro do estudo SHOCK, a mortalidade hospitalar em 30 dias de 1.217 pacientes que foram diagnosticados com SC secundária à insuficiência do ventrículo esquerdo (LV) ou do ventrículo direito (RV) devido a um IM agudo foi de 57% . Se você levar em consideração vários fatores de risco, especificamente choque na admissão, idade, cirurgia de revascularização do miocárdio (CABG), IM não inferior, creatinina > 1,9 mg / dL, PAS diminuída, anóxico lesão cerebral e evidência clínica de hipoperfusão de órgão-alvo, os pacientes poderiam ser subdivididos com mortalidade variando de 12% a 88% .11 No estudo GRACE, a SC diminuiu fracamente, mas significativamente entre 1999 e 2006, provavelmente devido ao aumento do uso de percutâneos intervenção coronária (ICP), uma forma importante de intervenção precoce para pacientes com IM complicado por CS.12 Mesmo quando estratificando os pacientes com base em fatores de risco, ICP e CRM beneficiaram pacientes de baixo e alto risco.11 O diagnóstico precoce e o tratamento apropriado permanecem, particularmente no caso de isquemia miocárdica, um importante contribuinte modificável para os resultados de pacientes com SC.
Além disso, quanto mais a SC progride, maior é a probabilidade de ocorrer uma inflamação desadaptativa resposta secundária a um aumento de citocinas como TNF-alfa e IL-6, que inibem a atividade cardíaca. 4,13 Há também aumento da vasopressina e da angiotensina II, que aumenta a pós-carga, piora o DC e aumenta a retenção de água e sal, causando edema pulmonar. O óxido nítrico (NO) também é aumentado pela ativação da NO sintase, levando à vasodilatação e depressão miocárdica. Todas essas respostas desadaptativas ao baixo CO e à isquemia miocárdica levam ao agravamento do dano ao tecido cardíaco, depressão do CO e choque distributivo. Deve-se observar que alguns casos de CE são iatrogênicos, quando pacientes à beira da insuficiência cardíaca são tratados com diuréticos agressivos, nitratos, betabloqueadores, IECA e morfina. 14 Portanto, como o primeiro médico a avaliar os pacientes, os médicos de emergência precisam identificar e tratar SC de uma maneira sensível ao tempo e clinicamente apropriada.
Avaliação clínica
Classicamente, pacientes com SC apresentar queixas de dispneia, dor no peito, fadiga e / ou inchaço no tornozelo.15 O exame físico pode revelar sinais de congestão, incluindo edema periférico, distensão venosa jugular (JVD), estertores crepitantes / estertores à ausculta e sinais de hipoperfusão, como frio, extremidades mal perfundidas (Tabela 2). Em uma pequena revisão retrospectiva de 30 pacientes em choque indiferenciado, aqueles com SC eram mais propensos a ter JVD (80% em comparação com 0% e 20%), pele fria (57,1% em comparação com 14,3% e 28,5%) e pulmonar estertores (75% vs 16,7% e 8,3%) em comparação com pacientes com choque distributivo e hipovolêmico, respectivamente.16 Em outro estudo prospectivo com 68 pacientes, os residentes usaram achados de exames clínicos específicos para diferenciar as categorias de choque. CS foi categorizado por PAS menor que 90, sinais de baixo débito (mãos frias, enchimento capilar pobre e pulso fraco), pressão venosa jugular elevada (JVP) > 7 cmH2O, S3 galope e crepita em 1/3 dos pulmões. De 68 pacientes, 11 preencheram os critérios para CS. Em pacientes com evidência ecocardiográfica de baixo débito cardíaco, a JVP elevada previu SC com uma precisão de 80%, que permaneceu inalterada ao adicionar a presença de crepitações.17
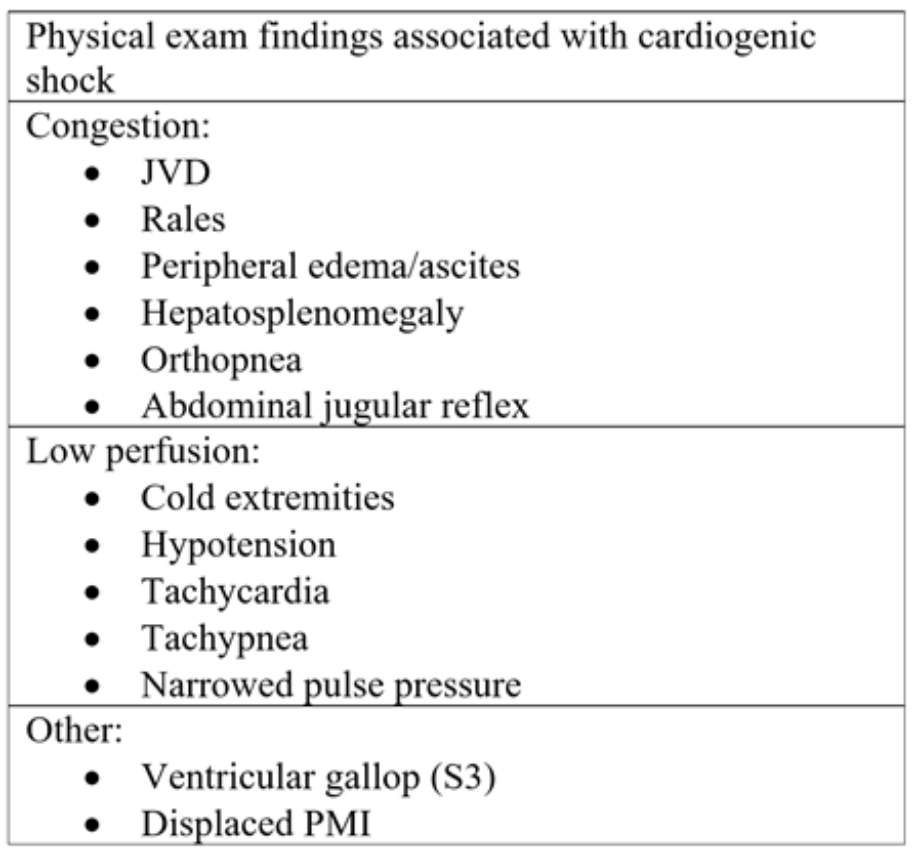
Tabela 2: Componentes do exame físico observados na insuficiência cardíaca aguda e choque cardiogênico subsequente.18
Embora JVP seja um proxy útil para pressões de cunha elevadas, 19 pode ser difícil de avaliar devido ao habitus corporal e ao posicionamento do paciente (a cabeceira da cama deve ser elevada 45 graus, o que pode ser difícil em pacientes com ortopneia grave) .20 A JVP é medida calculando o ponto de pulsação mais alto em cm acima do ângulo esternal e, em seguida, adicione 5 (já que o átrio direito está 5 cm abaixo do ângulo esternal), que se correlaciona com distensão em cmH20 (Figura 2). Valores elevados são frequentemente considerados maiores que 6-8 cmH20.18 Deve-se observar que a JVP elevada está associada a um risco aumentado de mortalidade, com um risco relativo (RR) de 1,52,18.
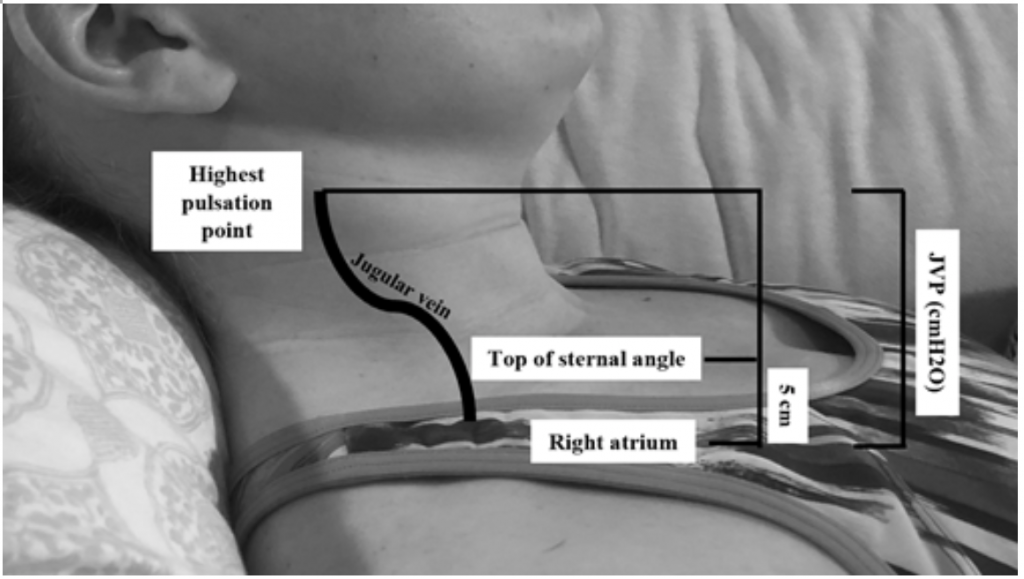
Figura 2: Medindo JVP, adaptado de Shah & Cowger (2014) .18
Os laboratórios podem mostrar uma acidose metabólica (conforme o lactato aumenta devido à isquemia periférica), hipoperfusão renal com lesão renal aguda resultante e possível evidência de isquemia cardíaca com troponina elevada e alterações no eletrocardiograma.15 No estudo CardShock, um estudo multicêntrico, prospectivo e observacional de 219 CS pacientes, os níveis de lactato foram significativamente associados ao aumento da mortalidade (odds ratio ajustada de 1,4) .6 É importante notar que a elevação do lactato não é específica para sepse e pode ser observada em qualquer estado de hipoperfusão, como CS.
Por outro lado, esses achados do exame físico e parâmetros hemodinâmicos nem sempre são verdadeiros. Em um estudo usando o registro SHOCK Trial, 5,2% dos pacientes com SC não apresentaram hipotensão evidente, embora apresentassem sinais de hipoperfusão periférica e baixo IC.21 Isso é provavelmente devido a uma liberação adaptativa de catecolaminas no início da SC, que aumenta a resistência vascular sistêmica ( SVR) e mantém temporariamente a pressão arterial, embora geralmente com uma pressão de pulso estreita.22 Mesmo pacientes com edema pulmonar clinicamente significativo na imagem podem apresentar sibilos ou mesmo sons pulmonares claros em vez de estertores.23 Em um estudo, a congestão pulmonar foi observada apenas em aproximadamente 2/3 casos de SC secundário a MI.21 Além disso, mesmo com a contratilidade do VE diminuída, os pacientes com SC podem não apresentar uma redução grave da FEVE. 14,24 Na verdade, a FE média em uma coorte de pacientes com SC é de cerca de 30%, o que é reduzido, mas maior do que o esperado.2
Embora o exame não seja perfeito, um exame físico detalhado em busca de sinais de congestão e hipoperfusão periférica, junto com uma revisão cuidadosa dos sinais vitais e laboratoriais, pode ser a primeira indicação de que seu paciente tem choque cardiogênico.
ECO de ponto de atendimento para avaliação de choque cardiogênico
Quando os pacientes se apresentam hipotensos ou hipoperfundidos na emergência, o exame RUSH é uma maneira rápida de diferenciar o choque observando a “bomba, o tanque e os tubos. ”25,26 Para SC, o ecocardiograma transtorácico demonstra classicamente um VE dilatado e hipodinâmico, com contração insuficiente do VE e movimento inadequado associado do folheto anterior da válvula mitral durante a sístole e diástole (isto é, contratilidade deficiente). Estimativa da fração de ejeção (FE) e CO (como CO = volume sistólico (VS) x frequência cardíaca (FC)) por meio de uma simples “observação” do aperto do VE é uma avaliação adequada por médicos em situações agudas.27 Em SC, a veia inferior cava (IVC), que é uma medida indireta da eficácia intra volume vascular, deve ter um diâmetro de > 2 cm de diâmetro e colapsos menos de 50% com a inspiração. Esses achados se correlacionam com uma pressão venosa central elevada.28 No entanto, a avaliação da VCI pode ser imprecisa se o paciente já recebeu vasodilatadores, diuréticos e / ou está ventilado.29 As janelas torácicas provavelmente mostram edema pulmonar na forma de B excessivo linhas (“foguetes pulmonares”) que são o resultado do espessamento septal do acúmulo de água no interstício.30 Junto com a congestão pulmonar, pode haver líquido pleural e peritoneal no exame RUSH.25 Em uma metanálise que usou dados de três dados originais artigos e dois relatos de caso, o protocolo RUSH mostrou ser sensível e específico (0,89 e 0,97, respectivamente) no diagnóstico de CS.31 Apesar de uma razão de verossimilhança positiva (LR) elevada resultante de 22,29, houve apenas uma negativa moderada LR de 0,17, sugerindo que o exame RUSH não é o teste perfeito para descartar SC. Portanto, o exame RUSH deve ser usado no contexto de uma história e exame físico cuidadosos, ao invés de ser usado isoladamente para diagnosticar cardiogênios. choque c.
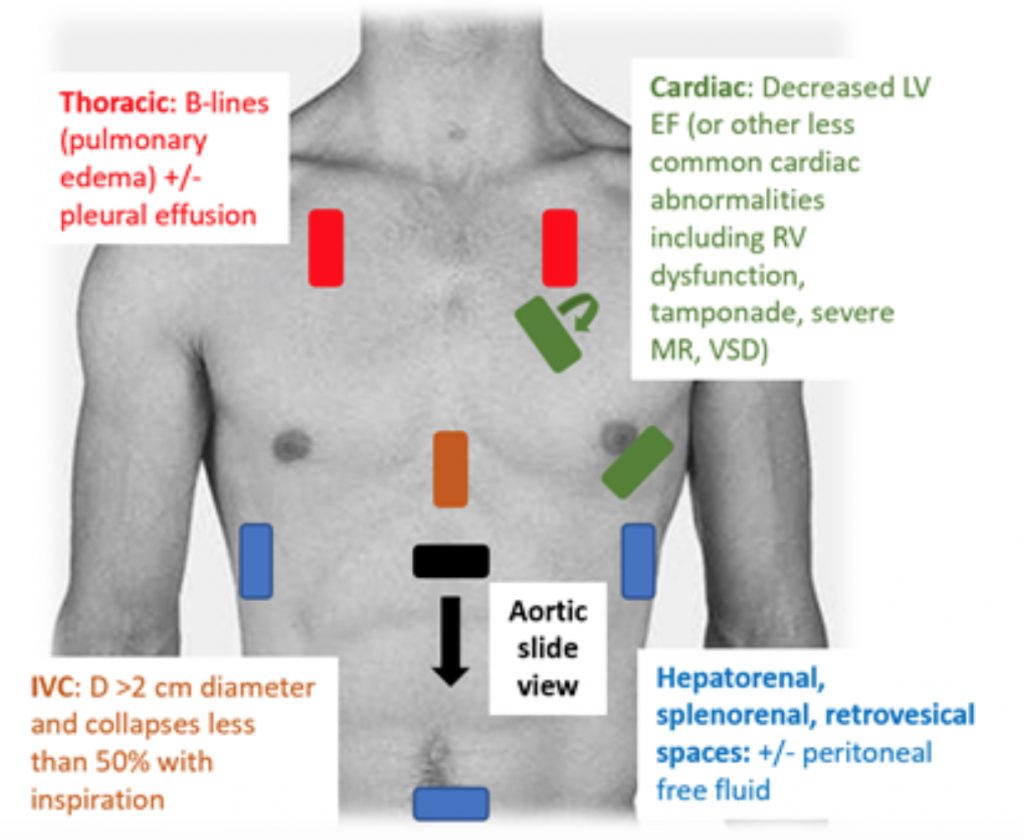
Figura 3: Exame US RUSH à beira do leito para a avaliação de hipotensão indiferenciada com achados associados sugestivos de CS.25 , 26,29,30
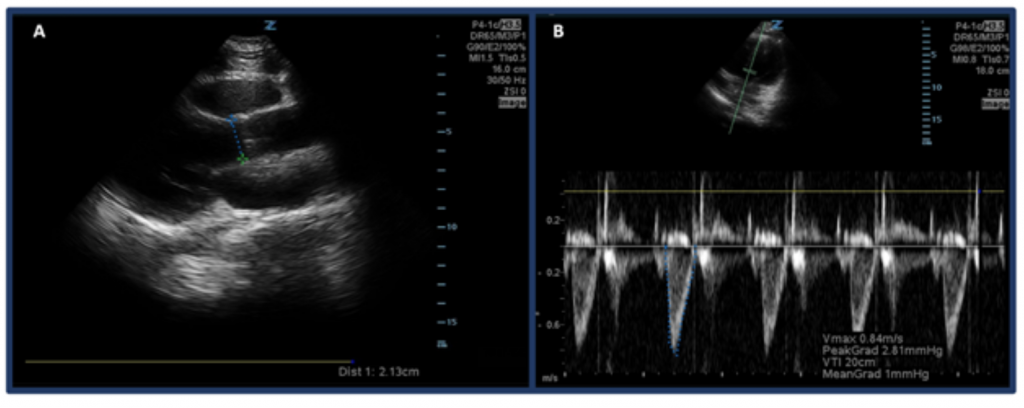
Em vez de apenas estimar o DC por meio de “exame ocular”, uma maneira de medir o DC com ultrassom é primeiro determinar VS usando o intervalo de tempo da velocidade do trato de saída do ventrículo esquerdo (VSVE VTI ou as velocidades do fluxo sanguíneo na via de saída da aorta) e diâmetro da VSVE. Especificamente, a VS, ou a quantidade de sangue ejetada através do ventrículo esquerdo por batimento, é calculada por VSVE VTI × área transversal da VSVE. 32 Para medir o diâmetro da VSVE, coloque a sonda de phased array na vista paraesternal eixo longo e meça o distância da VSVE logo acima da válvula aórtica no meio da sístole. O VTI é medido na visão apical de 5 câmaras. Usando o modo doppler de onda pulsada, a onda doppler é colocada logo acima da válvula aórtica e as formas de onda doppler são registradas. Certifique-se de alinhar o eixo com o trato de saída da melhor maneira possível para evitar super / subestimações. Após selecionar a ferramenta de medição “VSVE VTI”, meça a forma de onda de um período de ejeção.33,34 LVOT VTI normal varia de 18-22 cm, embora possivelmente mais baixo com HRs > 95 bpm. 35 Em pacientes com fibrilação atrial, as medidas de VTI provavelmente serão uma subestimação do valor verdadeiro e, portanto, sugere-se uma média de 3-5 formas de onda consecutivas. Como seria de se esperar, há uma correlação entre baixa VSVE VTI e resultados adversos.32
Caminho de avaliação recomendado
Conforme discutido acima, não há um único achado de exame ou teste de laboratório que possa diagnosticar CS. Portanto, quando há uma alta suspeita de CS no cenário de hipotensão ou sinais de hipoperfusão, sugerimos usar história, exame físico detalhado, US à beira do leito, laboratórios (especificamente creatinina, lactato, troponina, BNP e outros marcadores de hipoperfusão / dano ao órgão-alvo), e EKG (como MI agudo é a principal causa de CS e sinais de isquemia e pode exigir emergência revascularização) para auxiliar no diagnóstico (ver Figura 5). Considere um monitor de cateter arterial para a PA e orientar o tratamento. Além de um exame cardíaco e pulmonar focado, o exame físico deve se concentrar na JVD e na perfusão da extremidade. O exame RUSH e o cálculo de FE / CO / IC por meio de medições de VSVE VTI discutidos acima são complementos valiosos para a avaliação. Usar uma abordagem abrangente para avaliar a SC criará uma melhor compreensão desta doença heterogênea e ajudará a orientar o manejo.
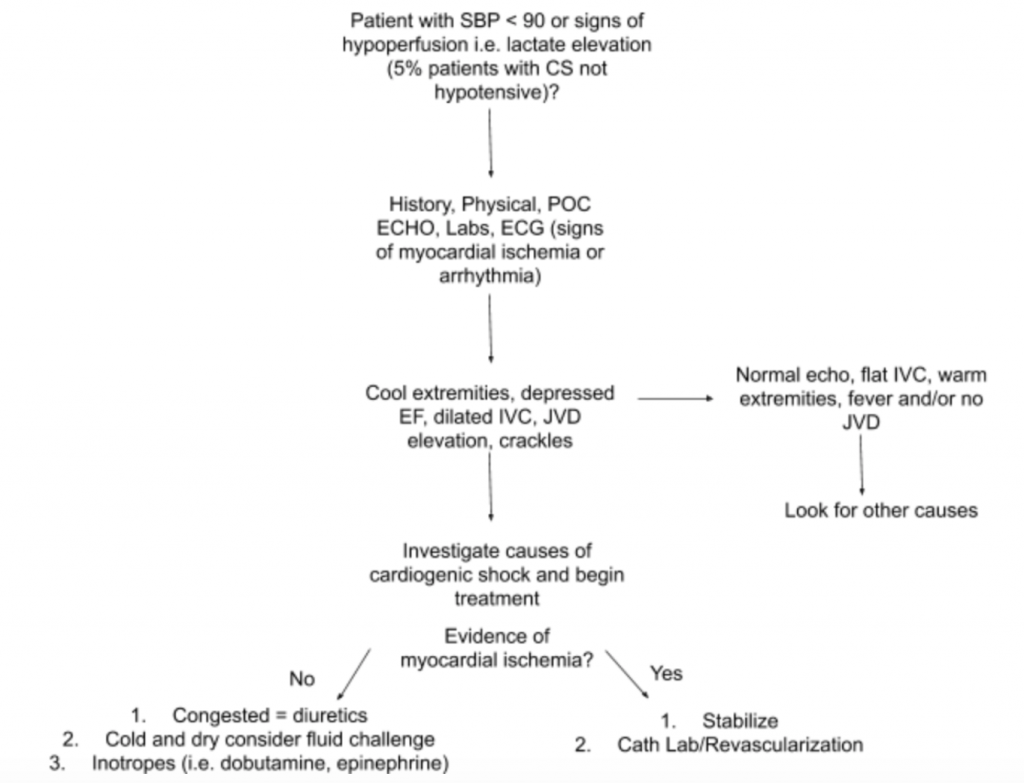
Conclusão do caso : Em uma avaliação posterior, a pressão venosa jugular do paciente é elevada para 10 cmH20, e seus pés estão frios com o enchimento capilar atrasado. O exame RUSH à beira do leito mostra edema pulmonar difuso bilateral e FE baixa estimada.LVOT VTI é medido em apenas 10 cm. O EKG mostra elevações de ST nas derivações precordiais. O lactato e a troponina estão ligeiramente elevados. O paciente é estabilizado com um breve ensaio de dobutamina, furosemida IV e CPAP com melhora moderada dos sinais vitais e do estado respiratório e, posteriormente, enviado ao laboratório de cateterismo para ICP de emergência.
Pontos para casa:
- CS é causado principalmente por um infarto do miocárdio (~ 70%) e é o foco da maioria dos estudos, mas outras causas também devem ser consideradas (ver lista completa na Figura 1).
- A mortalidade secundária a CS permanece alta (~ 60%), embora a identificação e intervenção precoces melhorem a sobrevida.
- Faça um exame físico cuidadoso procurando por hipoperfusão e congestionamento. JVP é um importante componente do exame físico para o diagnóstico de SC e está associado ao aumento da mortalidade (RR = 1,52).
- O exame RUSH é sensível e específico (0,89 e 0,97, respectivamente) no diagnóstico de CS. A ultrassonografia à beira do leito deve ser repetida com frequência, pois a maioria dos pacientes não apresenta inicialmente CS.
- O uso de LVOT VTI é um método simples e não invasivo para avaliar DC com baixas medições associadas a resultados adversos. Uma abordagem sugerida para avaliar pacientes com suspeita de SC com foco em sua patologia e apresentação heterogênea está resumida na Figura 5.
Recursos do FOAMed:
- EM em 5 : Choque
- emDocs: Choque cardiogênico
- emDocs: Gerenciamento de DE da insuficiência cardíaca – Pérolas e armadilhas
- emDocs: Protocolo RUSH (“Ultrassom rápido para choque”)
- emDocs: o paciente hipotensivo com DE: uma abordagem sistemática sequencial
- 10 primeiros EM: hipotensão indiferenciada
