Hoewel alle atomen van een element hetzelfde aantal protonen hebben, kunnen de atomen verschillen in het aantal neutronen dat ze hebben (Tabel 1-2). Deze verschillende atomen van hetzelfde element worden isotopen genoemd. Vier isotopen van helium (He) worden getoond in Figuur 1-1. Alle chlooratomen (Cl) hebben 17 protonen, maar er zijn chloorisotopen met 15 tot 23 neutronen. Slechts twee chloorisotopen bestaan in aanzienlijke hoeveelheden in de natuur, die met 18 neutronen (75,53% van alle chlooratomen die in de natuur worden aangetroffen) en die met 20 neutronen (24,47%). Om het symbool voor een isotoop te schrijven, plaatst u het atoomnummer als een subscript en het massagetal (protonen plus neutronen) als een superscript links van het atoomsymbool. De symbolen voor de twee natuurlijk voorkomende isotopen van chloor zijn dan  Cl en
Cl en 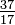 Cl. Strikt genomen is het subscript niet nodig, aangezien alle chlooratomen 17 protonen hebben. Daarom worden de isotoopsymbolen meestal zonder het subscript geschreven: 35Cl en 37Cl. Bij het bespreken van deze isotopen gebruiken we de. termen chloor-35 en chloor-37. Om een kern stabiel te houden, moet het aantal neutronen (voor de eerste paar elementen) gelijk zijn aan of iets groter zijn dan het aantal protonen. Hoe meer protonen, hoe groter de verhouding tussen neutronen en protonen om stabiliteit te garanderen. Kernen met te veel van beide soorten fundamentele deeltjes zijn onstabiel en breken radioactief af op manieren die worden besproken in hoofdstuk 23.
Cl. Strikt genomen is het subscript niet nodig, aangezien alle chlooratomen 17 protonen hebben. Daarom worden de isotoopsymbolen meestal zonder het subscript geschreven: 35Cl en 37Cl. Bij het bespreken van deze isotopen gebruiken we de. termen chloor-35 en chloor-37. Om een kern stabiel te houden, moet het aantal neutronen (voor de eerste paar elementen) gelijk zijn aan of iets groter zijn dan het aantal protonen. Hoe meer protonen, hoe groter de verhouding tussen neutronen en protonen om stabiliteit te garanderen. Kernen met te veel van beide soorten fundamentele deeltjes zijn onstabiel en breken radioactief af op manieren die worden besproken in hoofdstuk 23.

Voorbeeld 1.2.1
Hoeveel protonen, neutronen en elektronen zijn er in een atoom van de meest stabiele isotoop van uranium, uranium-238? Schrijf het symbool voor deze isotoop. Raadpleeg afbeelding. 1-1.
Oplossing
Het atoomnummer van uranium (zie de binnenkant van de achteromslag) is 92, en het massagetal van de isotoop wordt gegeven als 238. Daarom heeft het 92 protonen, 92 elektronen en 238 – 92 = 146 neutronen. Zijn symbool is  U (of 238U).
U (of 238U).
De totale massa van een atoom wordt zijn atoomgewicht genoemd, en dit is bijna maar niet precies de som van de massa’s van de samenstellende protonen, neutronen en elektronen. * Wanneer protonen, neutronen en elektronen samen een atoom vormen, wordt een deel van hun massa omgezet in energie en afgegeven. (Dit is de energiebron bij kernfusiereacties.) Omdat het atoom niet kan worden opgesplitst in zijn fundamentele deeltjes tenzij de energie voor de ontbrekende massa van buitenaf wordt geleverd, wordt deze energie de bindingsenergie van de kern genoemd.
Opmerking: atoomgewicht versus atoommassa
De termen atoomgewicht en molecuulgewicht worden universeel gebruikt door werkende wetenschappers en zullen in dit boek worden gebruikt, ook al zijn deze technisch gezien massa’s in plaats van gewichten.
| Elektronen | Protonen | Neutronen |
Atoom Getal |
Atoomgewicht (amu) |
Totale lading (elektroneneenheden) |
|
|---|---|---|---|---|---|---|
| Waterstofatoom, 1H of H | 1 | 1 | 0 | 1 | 1.008 | 0 |
| Deuteriumatoom, 2H of D | 1 | 1 | 1 | 1 | 2.014 | 0 |
| Tritiumatoom, 3H of T | 1 | 1 | 2 | 1 | 3.016 | 0 |
| Waterstofion, H + | 0 | 1 | 0 | 1 | 1.007 | +1 |
| Heliumatoom, 4He | 2 | 2 | 2 | 2 | 4.003 | 0 |
| Heliumkern of alfadeeltje, He2 + of α | 0 | 2 | 2 | 2 | 4.002 | +2 |
| Lithiumatoom, 7Li | 3 | 3 | 4 | 3 | 7.016 | 0 |
| Koolstofatoom, 12Ca | 6 | 6 | 6 | 6 | 12.000 | 0 |
| Zuurstofatoom, 16O | 8 | 8 | 8 | 8 | 15.995 | 0 |
| Chlooratoom, 35Cl | 17 | 17 | 18 | 17 | 34.969 | 0 |
| Chlooratoom, 37Cl | 17 | 17 | 20 | 17 | 36.966 | 0 |
| Natuurlijk voorkomend mengsel van chloor | 17 | 17 | 18 of 20 | 17 | 35.453 | 0 |
| Uraniumatoom, 234U | 92 | 92 | 142 | 92 | 234.04 | 0 |
| Uraniumatoom, 235U | 92 | 92 | 143 | 92 | 235.04 | 0 |
| Uraniumatoom, 238U | 92 | 92 | 146 | 92 | 238,05 | 0 |
| Natuurlijk voorkomend mengsel van uranium | 92 | 92 | gevarieerd | 92 | 238.03 | 0 |
Voorbeeld 1.2. 2
Bereken de massa die verloren gaat wanneer een koolstof-12-atoom wordt gevormd uit protonen, elektronen en neutronen.
Oplossing
Sinds de atoomkern mber van elk koolstofatoom is 6, koolstof-12 heeft 6 protonen en dus 6 elektronen. Om het aantal neutronen te vinden, trekken we het aantal protonen af van het massagetal: 12 – 6 = 6 neutronen. We kunnen de gegevens in Tabel 1-1 gebruiken om de totale massa van deze deeltjes te berekenen:
| Protonen: | 6 X 1.00728 amu = 6.04368 amu |
| Neutronen: | 6 X 1.00867 amu = 6.05202 amu |
| Elektronen: | 6 X 0.00055 amu = 0.00330 amu |
| Totale deeltjesmassa: 12.09900 amu |
Maar volgens de definitie van de schaal van atomaire massa-eenheden, is de massa van één koolstof-12-atoom precies 12 amu. Daarom is 0,0990 amu massa verdwenen tijdens het proces van het opbouwen van het atoom uit zijn deeltjes.
Voorbeeld 1.2.3
Bereken het verwachte atoomgewicht van de isotoop van chloor met 20 neutronen. Vergelijk dit met het werkelijke atoomgewicht van deze isotoop zoals gegeven in Tabel 1-2.
Oplossing
De chloorisotoop heeft 17 protonen en 20 neutronen:
| Protonen: | 17 x 1.00728 amu = | 17.1238 amu |
| Neutronen: | 20 X 1.00867 amu = | 20.1734 amu |
| Elektronen: | 17 X 0.00055 amu = | 0,0094 amu |
| Totale deeltjesmassa: | 37.3066 amu | |
| Werkelijk waargenomen atoomgewicht: | 36.966 amu | |
| Massaal verlies: | 0,341 amu |
Elke isotoop van een element wordt gekenmerkt door een atoomnummer (totaal aantal protonen), een massagetal (totaal aantal protonen s en neutronen), en een atoomgewicht (massa van atoom in atomaire massa-eenheden). Aangezien massaverliezen bij de vorming van een atoom klein zijn, is het massagetal gewoonlijk hetzelfde als het atoomgewicht afgerond op het dichtstbijzijnde gehele getal. (Het atoomgewicht van chloor-37 is bijvoorbeeld 36,966, wat wordt afgerond op 37.) Als er meerdere isotopen van een element in de natuur zijn, dan wordt natuurlijk het experimenteel waargenomen atoomgewicht (het natuurlijke atoomgewicht) gewogen gemiddelde van de isotoopgewichten. Het gemiddelde wordt gewogen volgens het percentage abondantie van de isotopen. Chloor komt in de natuur voor als 75,53% chloor-35 (34,97 amu) en 24,47% chloor-37 (36,97 amu), dus het gewogen gemiddelde van de isotoopgewichten is
\
De de atoomgewichten op de achteromslag van dit boek zijn allemaal gewogen gemiddelden van de isotopen die in de natuur voorkomen, en dit zijn de cijfers die we voortaan zullen gebruiken, tenzij we specifiek één isotoop bespreken. Alle isotopen van een element gedragen zich chemisch grotendeels op dezelfde manier. Hun gedrag zal verschillen met betrekking tot massa-gevoelige eigenschappen zoals diffusiesnelheden, die we later in dit boek zullen bekijken.
Voorbeeld 1.2.4
Magnesium ( Mg) heeft drie significante natuurlijke isotopen: 78,70% van alle magnesiumatomen heeft een atoomgewicht van 23,985 amu, 10,13% heeft een atoomgewicht van 24,986 amu en 11,17% heeft een atoomgewicht van 25,983 amu. Hoeveel protonen en neutronen zijn aanwezig in elk van deze drie isotopen? Hoe schrijven we de symbolen voor elke isotoop? Wat is tenslotte het gewogen gemiddelde van de atoomgewichten?
Oplossing
Er zijn in totaal 12 protonen magnesiumisotopen. De isotoop met een atoomgewicht van 23,985 amu heeft een massagetal van 24 (protonen en neutronen), dus 24 – 12 protonen geven 12 neutronen. Het symbool voor deze isotoop is 24 mg. Evenzo is de isotoop met een atoomgewicht 24.986 amu heeft een massagetal van 25, 13 neutronen en 25 mg als symbool. De derde isotoop (25.983 amu) heeft een massagetal van 26, 14 neutronen en 26 mg als symbool. We berekenen het gemiddelde atoomgewicht als volgt:
(0.7870 X 23.985) + (0.1013 X 24.986) + (0.1117 X 25.983) = 24.31 amu
Voorbeeld 1.2.5
Borium heeft twee natuurlijk voorkomende isotopen, lOB en 11B. We weten dat 80,22% van zijn atomen 11B zijn, atoomgewicht 11.009 amu. Bereken uit het natuurlijke atoomgewicht op de binnenkant van de achteromslag het atoomgewicht van de lOB-isotoop.
Oplossing
Als 80,22% van alle booratomen 11B zijn, dan is 100,00 – 80,22 , of 19,78%, zijn de onbekende isotoop. We kunnen W gebruiken om het onbekende atoomgewicht in onze berekening weer te geven:
(0.8022 X 11.009) + (0.1978 XW) = 10.81 amu (natuurlijk atoomgewicht) W =  = 10.01 amu
= 10.01 amu
Bijdragers en attributen
-
R. E. Dickerson, HB Gray en GP Haight, Jr. De inhoud werd gebruikt uit “Chemical Principles”, een inleidende tekst op universitair niveau voor algemene scheikunde met toestemming van de Caltech-bibliotheek en Harry B. Gray, namens de auteurs.
