元素のすべての原子は同じ数のプロトンを持っていますが、原子はそれらが持っている中性子の数が異なる場合があります(表1-2)。同じ元素のこれらの異なる原子は、同位体と呼ばれます。ヘリウム(He)の4つの同位体を図1-1に示します。塩素(Cl)のすべての原子には17個の陽子がありますが、15〜23個の中性子を持つ塩素同位体があります。自然界に存在する塩素同位体は、18個の中性子(自然界に存在するすべての塩素原子の75.53%)と20個の中性子(24.47%)の2つだけです。同位体の記号を書くには、原子番号を下付き文字として、質量数(陽子と中性子)を上付き文字として原子記号の左側に配置します。その場合、塩素の2つの天然同位体の記号は、 Clと
Clと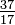 Clになります。厳密に言えば、塩素のすべての原子には17個のプロトンがあるため、下付き文字は不要です。したがって、同位体記号は通常、下付き文字なしで記述されます:35Clおよび37Cl。これらの同位体について説明する際に、を使用します。用語塩素-35および塩素-37。原子核が安定するためには、中性子の数が(最初のいくつかの元素について)陽子の数と等しいか、わずかに多い必要があります。陽子が多いほど、安定性を確保するために陽子に対する中性子の比率が大きくなります。いずれかの種類の素粒子が多すぎる原子核は不安定であり、第23章で説明されている方法で放射性分解します。
Clになります。厳密に言えば、塩素のすべての原子には17個のプロトンがあるため、下付き文字は不要です。したがって、同位体記号は通常、下付き文字なしで記述されます:35Clおよび37Cl。これらの同位体について説明する際に、を使用します。用語塩素-35および塩素-37。原子核が安定するためには、中性子の数が(最初のいくつかの元素について)陽子の数と等しいか、わずかに多い必要があります。陽子が多いほど、安定性を確保するために陽子に対する中性子の比率が大きくなります。いずれかの種類の素粒子が多すぎる原子核は不安定であり、第23章で説明されている方法で放射性分解します。

例1.2.1
陽子、中性子、電子の数はウランの最も安定な同位体であるウラン238の原子?この同位体の記号を書いてください。図を参照してください。 1-1。
解決策
ウランの原子番号(裏表紙の内側を参照)は92で、同位体の質量数は238です。したがって、92になります。陽子、92個の電子、および238-92 = 146個の中性子。その記号は U(または238U)です。
U(または238U)です。
原子の総質量は原子量と呼ばれますが、これはほとんどではありません。正確には、その構成要素である陽子、中性子、および電子の質量の合計です。 *陽子、中性子、電子が結合して原子を形成すると、それらの質量の一部がエネルギーに変換されて放出されます。 (これが核融合反応のエネルギー源です。)原子は、失われた質量のエネルギーが外部から供給されない限り、基本的な粒子に分解できないため、このエネルギーは核の結合エネルギーと呼ばれます。
注:原子量と原子量
原子量と分子量という用語は、働く科学者によって広く使用されており、技術的には使用されますが、この本では使用されます。重みではなく質量。
| 電子 | 陽子 | 中性子 |
原子 数 |
原子量 (amu) |
総電荷 (電子単位) |
|
|---|---|---|---|---|---|---|
| 水素原子、1HまたはH | 1 | 1 | 0 | 1 | 1.008 | 0 |
| 重水素原子、2HまたはD | 1 | 1 | 1 | 1 | 2.014 | 0 |
| トリチウム原子、3HまたはT | 1 | 1 | 2 | 1 | 3.016 | 0 |
| 水素イオン、H + | 0 | 1 | 0 | 1 | 1.007 | +1 |
| ヘリウム原子、4He | 2 | 2 | 2 | 2 | 4.003 | 0 |
| ヘリウム核またはアルファ粒子、He2 +またはα | 0 | 2 | 2 | 2 | 4.002 | +2 |
| リチウム原子、7Li | 3 | 3 | 4 | 3 | 7.016 | 0 |
| 炭素原子、12Ca | 6 | 6 | 6 | 6 | 12.000 | 0 |
| 酸素原子、160 | 8 | 8 | 8 | 8 | 15.995 | 0 |
| 塩素原子、35Cl | 17 | 17 | 18 | 17 | 34。969 | 0 |
| 塩素原子、37Cl | 17 | 17 | 20 | 17 | 36.966 | 0 |
| 天然に存在する塩素の混合物 | 17 | 17 | 18または20 | 17 | 35.453 | 0 |
| ウラン原子、234U | 92 | 92 | 142 | 92 | 234.04 | 0 |
| ウラン原子、235U | 92 | 92 | 143 | 92 | 235.04 | 0 |
| ウラン原子、238U | 92 | 92 | 146 | 92 | 238.05 | 0 |
| 天然に存在するウランの混合物 | 92 | 92 | 変動 | 92 | 238.03 | 0 |
例1.2。 2
炭素12の原子が陽子、電子、および中性子から形成されるときに失われる質量を計算します。
解決策
原子nuすべての炭素原子の数は6で、炭素12には6つの陽子、つまり6つの電子があります。中性子の数を見つけるために、質量数から陽子の数を引きます:12-6 = 6中性子。表1-1のデータを使用して、これらの粒子の総質量を計算できます。
| プロトン: | 6 X 1.00728 amu = 6.04368 amu |
| ニュートロン: | 6 X 1.00867 amu = 6.05202 amu |
| 電子: | 6 X 0.00055 amu = 0.00330 amu |
| 総粒子質量:12.09900 amu |
しかし、原子質量単位のスケールの定義によれば、1つの炭素12原子の質量は正確に12です。 amu。したがって、0.0990 amuの質量は、その粒子から原子を構築する過程で消えました。
例1.2.3
の予想される原子量を計算します。 20個の中性子を持つ塩素の同位体。これを、表1-2に示すこの同位体の実際の原子量と比較してください。
解決策
塩素同位体には、17個の陽子と20個の中性子があります。
| プロトン: | 17 X 1.00728 amu = | 17.1238 amu |
| 陽子: | 20 X 1.00867 amu = | 20.1734 amu |
| 電子: | 17 X 0.00055 amu = | 0.0094 amu |
| 総粒子質量: | 37.3066 amu | |
| 実際に観測された原子質量: | 36.966 amu | |
| 質量損失: | 0.341 amu |
要素の各同位体は、原子数(陽子の総数)、質量数(陽子の総数)によって特徴付けられます。 sと中性子)、および原子量(原子質量単位での原子の質量)。原子形成時の質量損失は小さいため、質量数は通常、最も近い整数に丸められた原子量と同じです。 (たとえば、塩素37の原子量は36.966で、37に丸められます。)自然界に元素の同位体が複数ある場合は、もちろん、実験的に観測された原子量(自然の原子量)が重み付けされます。同位体重量の平均。平均は、同位体の存在比に応じて重み付けされます。塩素は自然界では75.53%の塩素-35(34.97 amu)と24.47%の塩素-37(36.97 amu)として発生するため、同位体重量の加重平均は
\
この本の裏表紙に記載されている原子質量はすべて、自然界で発生する同位体の加重平均であり、これらは、1つの同位体について具体的に説明しない限り、今後使用する数値です。元素のすべての同位体は、ほとんどの場合、化学的に同じように動作します。それらの振る舞いは、拡散速度などの質量に敏感な特性に関して異なります。これについては、この本の後半で説明します。
例1.2.4
マグネシウム( Mg)には3つの重要な天然同位体があります:すべてのマグネシウム原子の78.70%の原子量は23.985 amu、10.13%の原子量は24.986 amu、11.17%の原子量は25.983amuです。存在するプロトンと中性子の数これら3つの同位体のそれぞれに?各同位体の記号をどのように書くのですか?最後に、原子量の加重平均は何ですか?
解決策
全部で12個のプロトンがありますマグネシウム同位体。原子量が23.985amuの同位体は、質量数が24(プロトンと中性子)であるため、24〜12個のプロトンは12個の中性子を生成します。この同位体の記号は24Mgです。同様に、原子量が24の同位体も同様です。986 amuの質量数は25、13中性子、25Mgです。 3番目の同位体(25.983 amu)の質量数は26、14中性子、記号として26Mgです。平均原子量は次のように計算されます:
(0.7870 X 23.985)+(0.1013 X 24.986)+(0.1117 X 25.983)= 24.31 amu
例1.2.5
ホウ素には、2つの天然同位体、10Bと11Bがあります。その原子の80.22%が11B、原子量11.009amuであることがわかっています。裏表紙の内側に記載されている自然原子量から、10B同位体の原子量を計算します。
解決策
すべてのホウ素原子の80.22%が11Bの場合、100.00〜80.22 、または19.78%は、未知の同位体です。 Wを使用して、計算で未知の原子量を表すことができます。
(0.8022 X 11.009)+(0.1978 XW)= 10.81 amu(自然原子量)W =  = 10.01 amu
= 10.01 amu
コントリビューターとアトリビューション
-
R。 E. Dickerson、HB Gray、およびGP Haight、Jr。のコンテンツは、著者に代わって、CaltechライブラリとHarry B. Grayの許可を得て、一般化学の大学レベルの入門テキストである「ChemicalPrinciples」から使用されました。
