Cas: Un homme de 73 ans avec des antécédents d’hypertension, de coronaropathie et de myocarde l’infarctus (IM) se présente au service d’urgence (SU) avec fatigue, essoufflement, diminution du débit urinaire et gonflement de la cheville. À son arrivée, ses signes vitaux incluent BP 87/58 mm Hg, HR 102, RR 24, saturation T 86% à l’air ambiant et température 98,2 F, et il a des crépitements à l’auscultation. Comment géreriez-vous ce patient?
Qu’est-ce qu’un choc cardiogénique?
Bien que les définitions varient, le choc cardiogénique (CS) est un diagnostic clinique largement défini comme un état de faible débit cardiaque associé perfusion inadéquate des organes terminaux ou hypoperfusion tissulaire secondaire à des lésions cardiaques. 1 Les critères couramment utilisés issus de l’essai SHOCK sont l’hypotension (SBP < 90 mmHg ou > 90 mmHg avec soins de soutien), preuve de hypoperfusion d’organe et index cardiaque (IC) < 2,2 L / min / m2 ou pression capillaire pulmonaire ≥ 15 mmHg 2,3 Bien que cette définition soit utile pour normaliser les critères d’inclusion pour les essais cliniques , il est moins utile pour diagnostiquer la CS au service des urgences (SU). Lors d’un quart de travail dans un service d’urgence chargé, la CS peut être difficile à diagnostiquer en raison de la diversité des présentations, du chevauchement avec d’autres états de choc (c.-à-d. Septicémie), de la pathophysiologie mal comprise, des causes complexes et multifactorielles et des paramètres hémodynamiques variés.4 En l’absence de débit cardiaque invasif Les valeurs (CO) et PCWP, CS peuvent être déduites en utilisant des preuves de pressions de remplissage élevées (c’est-à-dire une congestion pulmonaire ou une JVP élevée), des signes cliniques d’hypoperfusion et une histoire et un écho suggérant une insuffisance cardiaque. La mortalité secondaire à la CS est élevée (~ 25 à 70%), mais une reconnaissance et une intervention précoces améliorent la survie.4,5 Les médecins d’urgence ont la possibilité de diagnostiquer une CS à l’admission et doivent maintenir une forte suspicion clinique lorsqu’ils voient un patient gravement malade. Cette revue se concentrera sur la reconnaissance et des conseils sur la façon de ne pas manquer le diagnostic de CS grâce à un examen physique, des laboratoires, une échographie au chevet et une imagerie.
Quelles sont les causes du choc cardiogénique?
La plupart des études de CS se concentrent sur les patients atteints de CS secondaire à des infarctus du myocarde (IM) impliquant le ventricule gauche. Bien que les infarctus du myocarde soient la principale cause de CS (~ 70%), toute cause de dysfonctionnement ventriculaire et de réduction du CO ou de l’index cardiaque (CO / surface corporelle) doit être considérée comme une cause potentielle.6 Cela comprend, sans toutefois s’y limiter: causes non ischémiques d’insuffisance cardiaque droite, de myocardite, de cardiomyopathie takotsubo, de cardiomyopathie hypertrophique ou de cardiopathie valvulaire (tableau 1). Pour rendre les choses plus difficiles, la CS est un continuum plutôt qu’un état statique, allant de l’aggravation de l’insuffisance cardiaque au choc réfractaire avec des lésions irréversibles des organes terminaux (Figure 1). Le CS devient encore plus variable avec la survenue d’insultes secondaires telles que des arythmies ou une ischémie progressive et une acidose.3 Il est à noter que dans 2/3 des cas, le CS n’est pas présent à l’admission mais se développe plus tard dans les 48 heures suivant l’hospitalisation en tant que patient progresse le long du continuum du choc.7 Il est important de réévaluer fréquemment les signes vitaux, les symptômes, l’examen physique et l’écho au chevet des patients.

Tableau 1: Causes de CS, adapté de Parrillo & Dellinger (2013) .8 70% des cas de CS sont causés par des infarctus du myocarde aigu. pourcentages tirés des résultats du registre d’essai SHOCK.9.10
Figure 1: Continuum of CS, adapté de Bellumkonda et al . (2018) .3 Ce spectre peut dévier avec des insultes secondaires (ex. Nouvelles arythmies).
Mortalité en choc cardiogénique
Bien que la mortalité secondaire à la CS reste élevée, 4 reconnaissance et intervention précoces améliore la survie.5 En utilisant les données qui comprenaient le registre de l’essai SHOCK, la mortalité hospitalière à 30 jours de 1217 patients ayant reçu un diagnostic de CS secondaire à une défaillance du ventricule gauche (VG) ou du ventricule droit (RV) due à un IM aigu était de 57% . Si vous prenez en compte plusieurs facteurs de risque, en particulier le choc à l’admission, l’âge, le pontage coronarien antérieur (PAC), l’IM non inférieur, la créatinine > 1,9 mg / dL, diminution de la PAS, anoxique des lésions cérébrales et des preuves cliniques d’hypoperfusion des organes terminaux, les patients pourraient être subdivisés avec une mortalité allant de 12% à 88% .11 Dans l’essai GRACE, la CS a faiblement mais significativement diminué entre 1999 et 2006, probablement en raison de l’utilisation accrue de intervention coronarienne (PCI), une forme importante d’intervention précoce pour les patients atteints d’IM compliquée par CS.12 Même lors de la stratification des patients en fonction des facteurs de risque, l’ICP et le PAC ont bénéficié à la fois aux patients à faible et à haut risque.11 Le diagnostic précoce et le traitement approprié restent, en particulier dans le cas de l’ischémie myocardique, un important contributeur modifiable aux résultats pour les patients atteints de CS.
De plus, plus le CS progresse, plus il y aura une inflammation inadaptée réponse secondaire à une augmentation des cytokines comme le TNF-alpha et l’IL-6, qui inhibent l’activité cardiaque. 4,13 Il y a également une augmentation de la vasopressine et de l’angiotensine II, qui augmente la postcharge, aggrave le CO et augmente la rétention d’eau et de sel, provoquant ainsi un œdème pulmonaire. L’oxyde nitrique (NO) est également augmenté par l’activation de la NO synthase, conduisant à une vasodilatation et à une dépression myocardique. Toutes ces réponses inadaptées à un faible taux de CO et à une ischémie myocardique entraînent une aggravation des lésions tissulaires cardiaques, une diminution du CO et un choc distributif. Il convient de noter que certains cas de CS sont iatrogènes, lorsque les patients au bord de l’insuffisance cardiaque sont traités avec des diurétiques agressifs, des nitrates, des bêtabloquants, des IECA et de la morphine. 14 Par conséquent, en tant que premier médecin à évaluer les patients, les médecins urgentistes doivent identifier et traiter la CS d’une manière sensible au temps et cliniquement appropriée.
Évaluation clinique
Classiquement, les patients atteints de CS présentent des plaintes de dyspnée, de douleur thoracique, de fatigue et / ou de gonflement de la cheville.15 L’examen physique peut révéler des signes de congestion, y compris un œdème périphérique, une distension veineuse jugulaire (JVD), des crépitements / râles à l’auscultation et des signes d’hypoperfusion tels que froid, extrémités mal perfusées (tableau 2). Dans une petite revue rétrospective de 30 patients en état de choc indifférencié, ceux avec CS étaient plus susceptibles d’avoir JVD (80% contre 0% et 20%), peau froide (57,1% contre 14,3% et. 28,5%) et pulmonaire (75% vs 16,7% et 8,3%) par rapport aux patients présentant un choc distributif et hypovolémique, respectivement.16 Dans une autre étude prospective portant sur 68 patients, les résidents ont utilisé des résultats d’examens cliniques spécifiques pour différencier les catégories de choc. CS a été classé par SBP inférieur à 90, signes de faible débit (mains froides, mauvaise recharge capillaire et pouls faible), pression veineuse jugulaire élevée (JVP) > 7 cmH2O, galop S3 et crépitements à 1/3 des poumons. Sur 68 patients, 11 répondaient aux critères de CS. Chez les patients présentant des signes échocardiographiques de faible débit cardiaque, une JVP élevée prédisait le CS avec une précision de 80%, qui était inchangée lors de l’ajout de la présence de crépitements.17
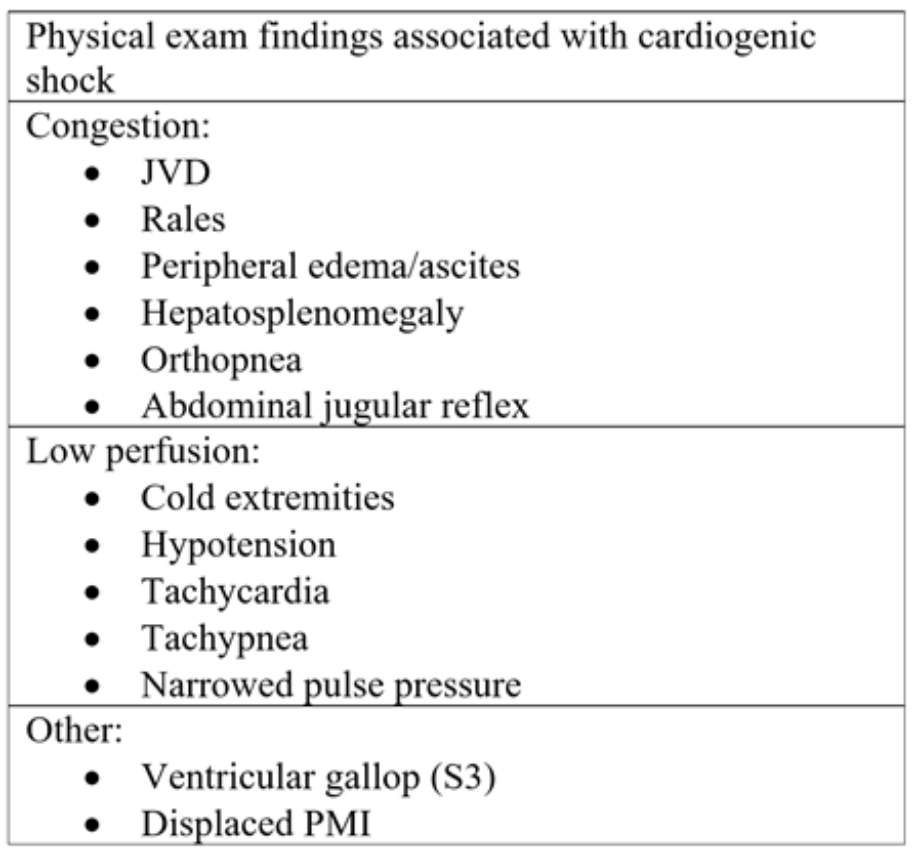
Tableau 2: Composantes de l’examen physique observées dans l’insuffisance cardiaque aiguë et le choc cardiogénique subséquent.18
Bien que JVP soit un proxy utile pour les pressions de coin élevées, 19 il peut être difficile à évaluer en raison de l’habitus corporel et du positionnement du patient (la tête du lit doit être surélevée de 45 degrés, ce qui peut être difficile chez les patients souffrant d’orthopnée sévère) .20 JVP est mesurée en calculant le point de pulsation le plus élevé en cm au-dessus de l’angle sternal, puis en ajoutant 5 (car l’oreillette droite est 5 cm en dessous de l’angle sternal), ce qui correspond à la distension en cmH20 (Figure 2). Les valeurs élevées sont souvent considérées comme supérieures à 6-8 cmH20.18 À noter, une JVP élevée est associée à un risque accru de mortalité, avec un risque relatif (RR) de 1,52,18
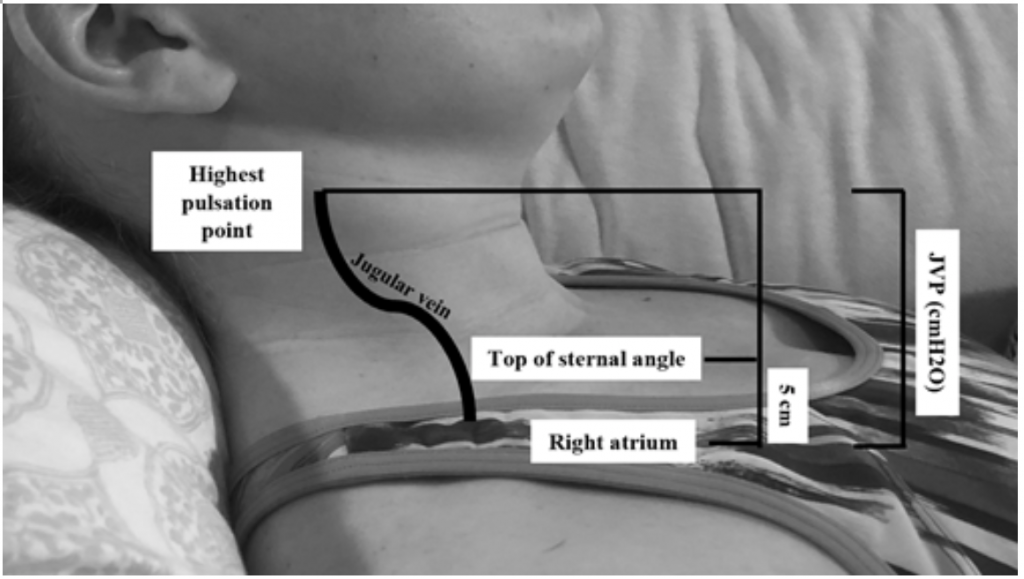
Figure 2: Mesurer JVP, adapté de Shah & Cowger (2014) .18
Les laboratoires peuvent afficher une acidose métabolique (lorsque le lactate augmente en raison d’une ischémie périphérique), une hypoperfusion rénale avec une lésion rénale aiguë résultante, et des signes possibles d’ischémie cardiaque avec des modifications élevées de la troponine et de l’ECG.15 Dans l’étude CardShock, une étude multicentrique, prospective et observationnelle de 219 CS patients, les taux de lactate étaient significativement associés à une mortalité accrue (odds ratio ajusté de 1,4) .6 Il est important de noter que l’élévation du lactate n’est pas spécifique à la septicémie et peut être observée dans tout état d’hypoperfusion tel que le CS.
En revanche, ces résultats de l’examen physique et ces paramètres hémodynamiques ne sont pas toujours valables. Dans une étude utilisant le registre de l’essai SHOCK, 5,2% des patients atteints de CS n’avaient pas d’hypotension manifeste, bien qu’ils présentaient des signes d’hypoperfusion périphérique et d’IC faible.21 Cela est probablement dû à une libération adaptative de catécholamines au début de la CS, ce qui augmente la résistance vasculaire systémique ( SVR) et maintient temporairement la pression artérielle, bien que généralement avec une pression différentielle étroite.22 Même les patients présentant un œdème pulmonaire cliniquement significatif à l’imagerie peuvent présenter une respiration sifflante ou même des sons pulmonaires clairs plutôt que des râles.23 Dans une étude, la congestion pulmonaire n’a été observée que dans environ 2/3 des cas de CS secondaire à un infarctus du myocarde.21 De plus, même avec une contractilité réduite du VG, les patients CS peuvent ne pas avoir de réduction sévère de la FEVG. 14,24 En fait, la FE moyenne dans une cohorte de patients CS est d’environ 30%, ce qui est réduit mais plus élevé que prévu.2
Bien que l’examen ne soit pas parfait, un examen physique détaillé à la recherche de signes de congestion et d’hypoperfusion périphérique ainsi qu’un examen attentif des signes vitaux et des laboratoires peuvent être le premier indice que votre patient a un choc cardiogénique.
ECHO au point de service pour l’évaluation du choc cardiogénique
Lorsque les patients se présentent au SU hypotendus ou hypoperfusés, l’examen RUSH est un moyen rapide de différencier le choc en regardant la «pompe, le réservoir et les tuyaux. »25,26 Pour le CS, l’échocardiogramme transthoracique démontre classiquement un VG hypodynamique et dilaté, avec une faible compression du VG et un mouvement inadéquat associé de la foliole antérieure de la valve mitrale pendant la systole et la diastole (c.-à-d. une mauvaise contractilité). L’estimation de la fraction d’éjection (FE) et du CO (sous forme de CO = volume systolique (SV) x fréquence cardiaque (FC)) par une simple compression du VG « oculaire » est une évaluation adéquate par les médecins en situation aiguë.27 En CS, la veine inférieure cava (IVC), qui est une mesure indirecte de l’efficacité intra volume vasculaire, doit avoir un diamètre de > 2 cm de diamètre et s’effondre à moins de 50% avec l’inspiration. Ces résultats sont en corrélation avec une pression veineuse centrale élevée.28 Cependant, l’évaluation de la VCI peut être inexacte si le patient a déjà reçu des vasodilatateurs, des diurétiques et / ou est ventilé.29 Les fenêtres thoraciques sont susceptibles de montrer un œdème pulmonaire sous la forme d’un excès de B («fusées pulmonaires») qui sont le résultat de l’épaississement septal de l’accumulation d’eau dans l’interstitium.30 Parallèlement à la congestion pulmonaire, il peut y avoir du liquide pleural et péritonéal à l’examen RUSH.25 Dans une méta-analyse qui a utilisé les données de trois et deux rapports de cas, le protocole RUSH s’est avéré à la fois sensible et spécifique (0,89 et 0,97, respectivement) dans le diagnostic de CS.31 Malgré un rapport de vraisemblance positif (RV) élevé de 22,29, il n’y avait qu’un LR de 0,17, ce qui suggère que l’examen RUSH n’est pas le test parfait pour exclure la CS. Par conséquent, l’examen RUSH doit être utilisé dans le contexte d’une anamnèse minutieuse et d’un examen physique plutôt que d’être utilisé seul pour diagnostiquer une cardiogeni c choc.
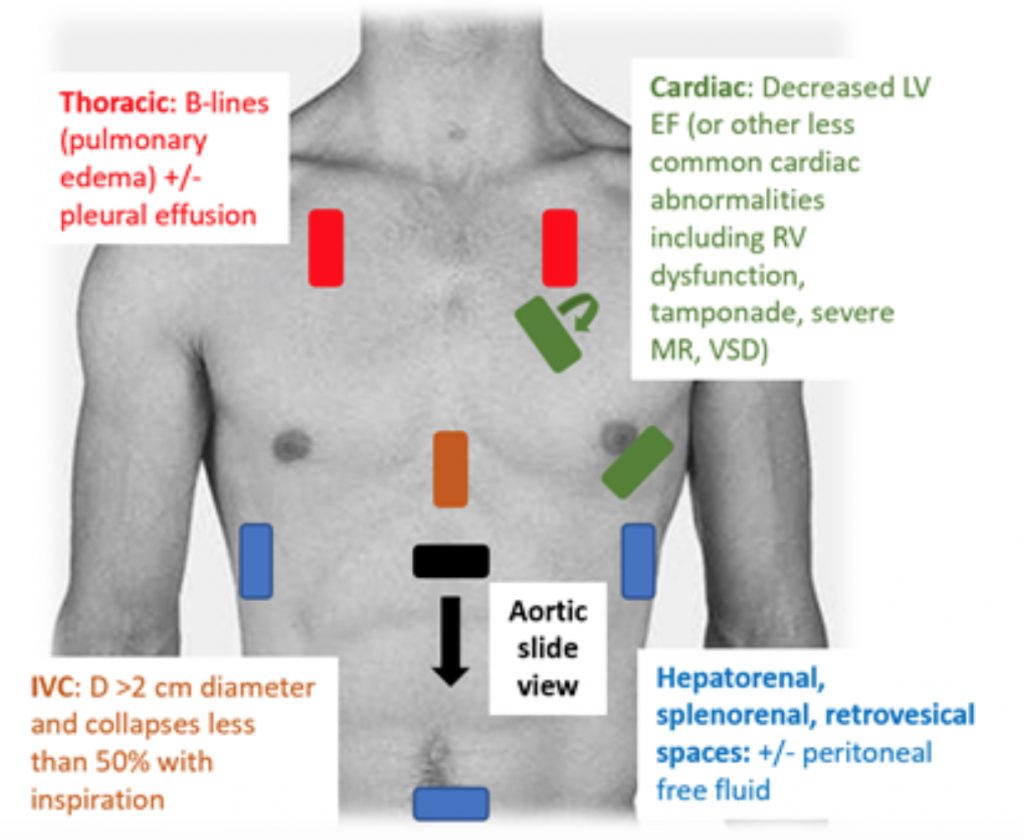
Figure 3: Examen américain RUSH au chevet pour l’évaluation de l’hypotension indifférenciée avec des résultats associés suggérant un CS.25 , 26,29,30
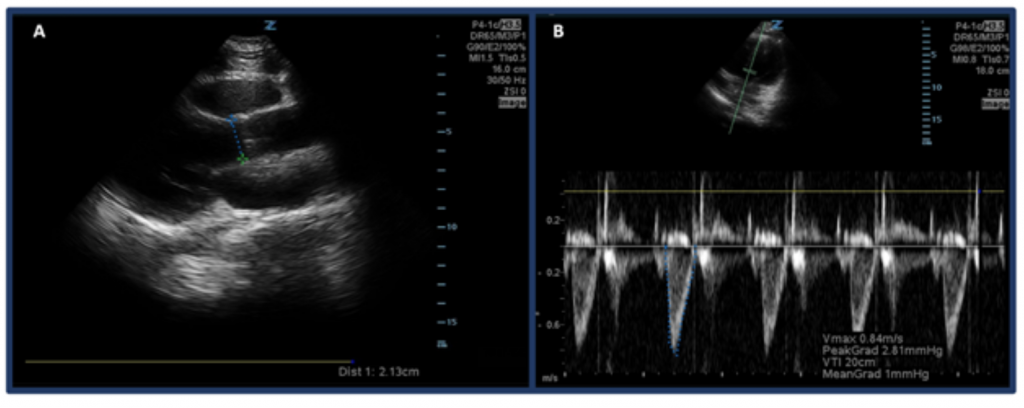
Plutôt que de simplement estimer le CO par « eyeballing », une façon de mesurer le CO avec des ultrasons consiste d’abord à déterminer SV en utilisant l’intervalle de temps de vitesse de sortie ventriculaire gauche (LVOT VTI, ou les vitesses du flux sanguin au niveau de la voie de sortie aortique) et le diamètre LVOT. Plus précisément, SV, ou la quantité de sang éjecté par le ventricule gauche par battement, est calculée par LVOT VTI × section transversale du LVOT .32 Pour mesurer le diamètre du LVOT, placez la sonde à réseau phasé dans la vue à grand axe parasternal et mesurez le distance du LVOT juste au-dessus de la valve aortique en milieu de systole. Le VTI est mesuré dans la vue apicale à 5 chambres. En utilisant le mode doppler à onde pulsée, l’onde doppler est placée juste au-dessus de la valve aortique et les formes d’onde doppler sont enregistrées. Assurez-vous d’aligner au mieux l’axe avec la voie de sortie pour éviter les sur / sous-estimations. Après avoir sélectionné l’outil de mesure «LVOT VTI», mesurez la forme d’onde d’une période d’éjection. 33,34 LVOT VTI normal varie de 18 à 22 cm, bien que probablement plus bas avec des FC > 95 bpm. 35 Chez les patients atteints de fibrillation auriculaire, les mesures de VTI seront probablement une sous-estimation de la valeur réelle, et donc une moyenne de 3 à 5 formes d’onde consécutives est suggérée. Comme on pouvait s’y attendre, il existe une corrélation entre un faible LVOT VTI et des résultats indésirables.32
Voie d’évaluation recommandée
Comme indiqué ci-dessus, il n’y a pas un seul examen ou test de laboratoire qui puisse diagnostiquer CS. Par conséquent, en cas de forte suspicion de CS dans le cadre d’une hypotension ou de signes d’hypoperfusion, nous suggérons d’utiliser les antécédents, un examen physique détaillé, des échographies au chevet du patient, des laboratoires (en particulier la créatinine, le lactate, la troponine, le BNP et d’autres marqueurs de l’hypoperfusion. / dommages aux organes terminaux) et électrocardiogramme (car l’infarctus du myocarde aigu est la principale cause de CS et de signes d’ischémie et peut nécessiter revascularisation) pour faciliter le diagnostic (voir la figure 5). Envisagez un cathéter artériel pour contrôler la TA et guider le traitement. Au-delà d’un examen cardiaque et pulmonaire ciblé, l’examen physique doit se concentrer sur la JVD et la perfusion des extrémités. L’examen RUSH et le calcul d’EF / CO / CI par les mesures LVOT VTI discutés ci-dessus sont des compléments précieux à l’évaluation. L’utilisation d’une approche globale pour évaluer la CS permettra de mieux comprendre cette maladie hétérogène et de guider la prise en charge.
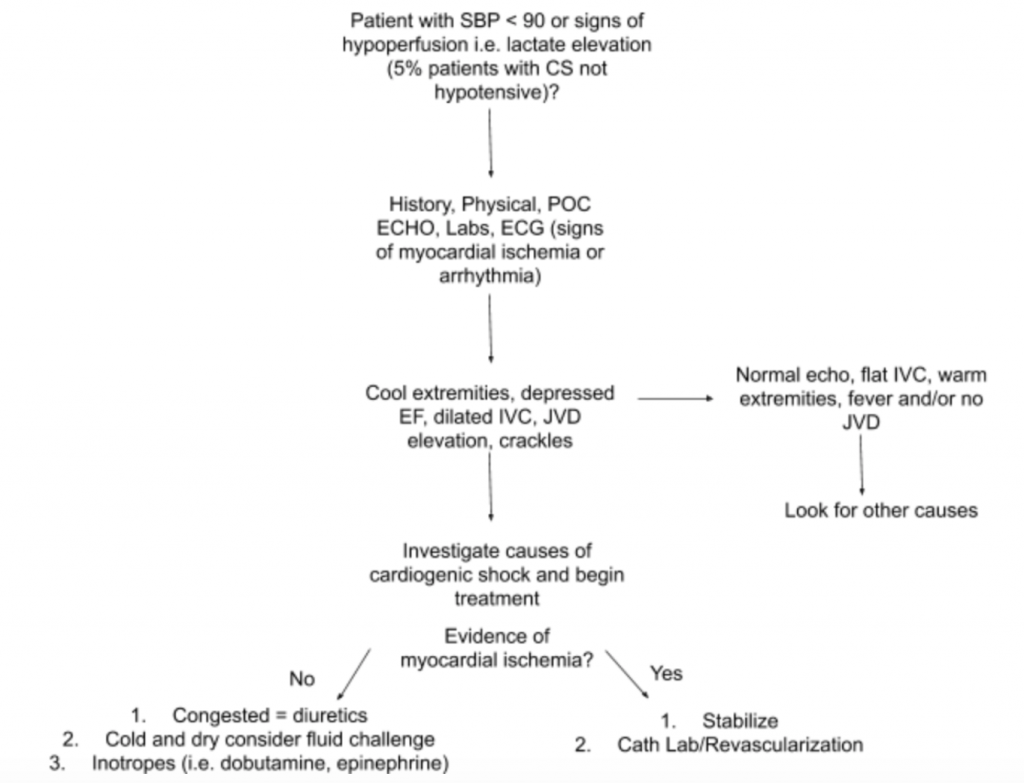
Conclusion du cas : Lors d’une évaluation plus approfondie, la pression veineuse jugulaire du patient est élevée à 10 cmH20 et ses pieds sont froids avec un remplissage capillaire retardé. L’examen RUSH au chevet montre un œdème pulmonaire diffus bilatéral et une FE basse estimée.LVOT VTI est mesuré à seulement 10 cm. L’ECG montre les élévations de ST dans les dérivations précordiales. Le lactate et la troponine sont légèrement élevés. Le patient est stabilisé avec un court essai de dobutamine, de furosémide IV et de CPAP avec une amélioration modérée des signes vitaux et de l’état respiratoire, puis envoyé au laboratoire de cathétérisme pour une ICP émergente.
Points à retenir:
- La CS est principalement causée par un infarctus du myocarde aigu (~ 70%) et fait l’objet de la plupart des études, mais d’autres causes doivent également être prises en compte (voir liste complète de la figure 1).
- La mortalité secondaire à la CS reste élevée (~ 60%), bien qu’une identification et une intervention précoces améliorent la survie.
- Effectuez un examen physique attentif à la recherche d’une hypoperfusion et congestion. Le JVP est un élément important de l’examen physique pour le diagnostic de CS et est associé à une mortalité accrue (RR = 1,52).
- L’examen RUSH est à la fois sensible et spécifique (0,89 et 0,97, respectivement) dans le diagnostic de CS. L’échographie au chevet doit être répétée fréquemment car la plupart des patients ne présentent pas initialement de CS.
- L’utilisation de LVOT VTI est une méthode simple et non invasive pour évaluer le CO avec des mesures faibles associées à des résultats indésirables.
- Une approche suggérée pour évaluer les patients avec suspicion de CS en mettant l’accent sur sa pathologie hétérogène et sa présentation est résumée dans la figure 5.
Ressources FOAMed:
- EM in 5 : Shock
- emDocs: Cardiogenic Shock
- emDocs: ED Management of Heart Failure – Pearls and Pitfalls
- emDocs: Protocole RUSH (« Rapid Ultrasound for Shock »)
- emDocs: Le patient hypotendu à l’urgence: une approche systématique séquentielle
- 10 premiers EM: hypotension indifférenciée
