Aunque todos los átomos de un elemento tienen el mismo número de protones, los átomos pueden diferir en el número de neutrones que tienen (Tabla 1-2). Estos átomos diferentes del mismo elemento se denominan isótopos. En la Figura 1-1 se muestran cuatro isótopos de helio (He). Todos los átomos de cloro (Cl) tienen 17 protones, pero hay isótopos de cloro que tienen de 15 a 23 neutrones. Solo existen dos isótopos de cloro en cantidades significativas en la naturaleza, los que tienen 18 neutrones (75,53% de todos los átomos de cloro que se encuentran en la naturaleza) y los que tienen 20 neutrones (24,47%). Para escribir el símbolo de un isótopo, coloque el número atómico como subíndice y el número de masa (protones más neutrones) como superíndice a la izquierda del símbolo atómico. Los símbolos de los dos isótopos naturales del cloro serían  Cl y
Cl y 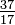 Cl. Estrictamente hablando, el subíndice es innecesario, ya que todos los átomos de cloro tienen 17 protones. Por lo tanto, los símbolos isotópicos generalmente se escriben sin el subíndice: 35Cl y 37Cl. Al discutir estos isótopos, usamos. términos cloro-35 y cloro-37. Para que un núcleo sea estable, el número de neutrones debe (para los primeros elementos) igualar o superar ligeramente el número de protones. Cuantos más protones, mayor es la relación entre neutrones y protones para garantizar la estabilidad. Los núcleos que tienen demasiados tipos de partículas fundamentales son inestables y se descomponen radiactivamente de las formas que se describen en el Capítulo 23.
Cl. Estrictamente hablando, el subíndice es innecesario, ya que todos los átomos de cloro tienen 17 protones. Por lo tanto, los símbolos isotópicos generalmente se escriben sin el subíndice: 35Cl y 37Cl. Al discutir estos isótopos, usamos. términos cloro-35 y cloro-37. Para que un núcleo sea estable, el número de neutrones debe (para los primeros elementos) igualar o superar ligeramente el número de protones. Cuantos más protones, mayor es la relación entre neutrones y protones para garantizar la estabilidad. Los núcleos que tienen demasiados tipos de partículas fundamentales son inestables y se descomponen radiactivamente de las formas que se describen en el Capítulo 23.

Ejemplo 1.2.1
¿Cuántos protones, neutrones y electrones hay en ¿un átomo del isótopo más estable de uranio, el uranio-238? Escribe el símbolo de este isótopo. Consulte la Figura. 1-1.
Solución
El número atómico del uranio (ver la contraportada interior) es 92, y el número de masa del isótopo se da como 238. Por lo tanto, tiene 92 protones, 92 electrones y 238 – 92 = 146 neutrones. Su símbolo es  U (o 238U).
U (o 238U).
La masa total de un átomo se llama peso atómico, y esto es casi, pero no exactamente la suma de las masas de sus protones, neutrones y electrones constituyentes. * Cuando los protones, neutrones y electrones se combinan para formar un átomo, parte de su masa se convierte en energía y se desprende. (Esta es la fuente de energía en las reacciones de fusión nuclear.) Debido a que el átomo no se puede descomponer en sus partículas fundamentales a menos que la energía para la masa faltante se suministre desde fuera, esta energía se llama energía de enlace del núcleo.
Nota: peso atómico frente a masa atómica
Los términos peso atómico y peso molecular son utilizados universalmente por los científicos que trabajan y se utilizarán en este libro, aunque técnicamente son masas en lugar de pesos.
| Electrones | Protones | Neutrones |
Atómico Número |
Peso atómico (amu) |
Carga total (unidades de electrones) |
|
|---|---|---|---|---|---|---|
| Átomo de hidrógeno, 1H o H | 1 | 1 | 0 | 1 | 1.008 | 0 |
| Átomo de deuterio, 2H o D | 1 | 1 | 1 | 1 | 2.014 | 0 |
| Átomo de tritio, 3H o T | 1 | 1 | 2 | 1 | 3.016 | 0 |
| Ion hidrógeno, H + | 0 | 1 | 0 | 1 | 1.007 | +1 |
| Átomo de helio, 4He | 2 | 2 | 2 | 2 | 4.003 | 0 |
| Núcleo de helio o partícula alfa, He2 + o α | 0 | 2 | 2 | 2 | 4.002 | +2 |
| Átomo de litio, 7Li | 3 | 3 | 4 | 3 | 7.016 | 0 |
| Átomo de carbono, 12Ca | 6 | 6 | 6 | 6 | 12.000 | 0 |
| Átomo de oxígeno, 16O | 8 | 8 | 8 | 8 | 15.995 | 0 |
| Átomo de cloro, 35Cl | 17 | 17 | 18 | 17 | 34.969 | 0 |
| Átomo de cloro, 37Cl | 17 | 17 | 20 | 17 | 36.966 | 0 |
| Mezcla natural de cloro | 17 | 17 | 18 o 20 | 17 | 35.453 | 0 |
| Átomo de uranio, 234U | 92 | 92 | 142 | 92 | 234.04 | 0 |
| Átomo de uranio, 235U | 92 | 92 | 143 | 92 | 235.04 | 0 |
| Átomo de uranio, 238U | 92 | 92 | 146 | 92 | 238.05 | 0 |
| Mezcla natural de uranio | 92 | 92 | variada | 92 | 238.03 | 0 |
Ejemplo 1.2. 2
Calcula la masa que se pierde cuando un átomo de carbono-12 se forma a partir de protones, electrones y neutrones.
Solución
Dado que el núcleo atómico mber de cada átomo de carbono es 6, el carbono-12 tiene 6 protones y por lo tanto 6 electrones. Para encontrar el número de neutrones, restamos el número de protones del número de masa: 12 – 6 = 6 neutrones. Podemos usar los datos de la Tabla 1-1 para calcular la masa total de estas partículas:
| Protones: | 6 X 1.00728 amu = 6.04368 amu |
| Neutrones: | 6 X 1.00867 amu = 6.05202 amu |
| Electrones: | 6 X 0.00055 amu = 0.00330 amu |
| Masa total de partículas: 12.09900 amu |
Pero según la definición de la escala de unidades de masa atómica, la masa de un átomo de carbono-12 es exactamente 12 amu. Por lo tanto, 0.0990 amu de masa han desaparecido en el proceso de construcción del átomo a partir de sus partículas.
Ejemplo 1.2.3
Calcule el peso atómico esperado del isótopo de cloro que tiene 20 neutrones. Compare esto con el peso atómico real de este isótopo como se muestra en la Tabla 1-2.
Solución
El isótopo de cloro tiene 17 protones y 20 neutrones:
| Protones: | 17 X 1.00728 amu = | 17.1238 amu |
| Neutrones: | 20 X 1.00867 amu = | 20.1734 amu |
| Electrones: | 17 X 0.00055 amu = | 0.0094 amu |
| Masa total de partículas: | 37.3066 amu | |
| Peso atómico real observado: | 36,966 uma | |
| Pérdida masiva: | 0.341 amu |
Cada isótopo de un elemento se caracteriza por un número atómico (número total de protones), un número de masa (número total de protones sy neutrones) y un peso atómico (masa del átomo en unidades de masa atómica). Dado que las pérdidas de masa en la formación de un átomo son pequeñas, el número de masa suele ser el mismo que el peso atómico redondeado al número entero más cercano. (Por ejemplo, el peso atómico del cloro-37 es 36,966, que se redondea a 37). Si hay varios isótopos de un elemento en la naturaleza, entonces, por supuesto, el peso atómico observado experimentalmente (el peso atómico natural) será el ponderado promedio de los pesos isotópicos. El promedio se pondera según el porcentaje de abundancia de los isótopos. El cloro se presenta en la naturaleza como 75.53% de cloro-35 (34.97 amu) y 24.47% de cloro-37 (36.97 amu), por lo que el promedio ponderado de los pesos de los isótopos es
\
El Los pesos atómicos que se dan en el interior de la contraportada de este libro son todos los promedios ponderados de los isótopos que ocurren en la naturaleza, y estas son las cifras que usaremos de ahora en adelante, a menos que estemos discutiendo específicamente un isótopo. Todos los isótopos de un elemento se comportan químicamente de la misma manera en su mayor parte. Su comportamiento será diferente con respecto a las propiedades sensibles a la masa, como las velocidades de difusión, que veremos más adelante en este libro.
Ejemplo 1.2.4
Magnesio ( Mg) tiene tres isótopos naturales significativos: 78,70% de todos los átomos de magnesio tienen un peso atómico de 23,985 amu, 10,13% tienen un peso atómico de 24,986 amu y 11,17% tienen un peso atómico de 25,983 amu. ¿Cuántos protones y neutrones están presentes? en cada uno de estos tres isótopos? ¿Cómo escribimos los símbolos para cada isótopo? Finalmente, ¿cuál es el promedio ponderado de los pesos atómicos?
Solución
Hay 12 protones en total isótopos de magnesio. El isótopo cuyo peso atómico es 23,985 amu tiene un número de masa de 24 (protones y neutrones), por lo que 24 – 12 protones dan 12 neutrones. El símbolo de este isótopo es 24Mg. De manera similar, el isótopo cuyo peso atómico es 24.986 amu tiene un número de masa de 25, 13 neutrones y 25Mg como símbolo. El tercer isótopo (25,983 amu) tiene un número de masa de 26, 14 neutrones y 26Mg como símbolo. Calculamos el peso atómico promedio de la siguiente manera:
(0.7870 X 23.985) + (0.1013 X 24.986) + (0.1117 X 25.983) = 24.31 amu
Ejemplo 1.2.5
El boro tiene dos isótopos naturales, IOB y 11B. Sabemos que el 80,22% de sus átomos son 11B, peso atómico 11,009 amu. A partir del peso atómico natural que figura en la contraportada interior, calcule el peso atómico del isótopo LOB.
Solución
Si el 80,22% de todos los átomos de boro son 11B, entonces 100,00 – 80,22 , o el 19,78%, son el isótopo desconocido. Podemos utilizar W para representar el peso atómico desconocido en nuestro cálculo:
(0,8022 X 11,009) + (0,1978 XW) = 10,81 amu (peso atómico natural) W =  = 10.01 amu
= 10.01 amu
Contribuyentes y Atribuciones
-
R. E. Dickerson, HB Gray y GP Haight, Jr. Se utilizó contenido de «Principios químicos», un texto introductorio de nivel universitario para Química general con permiso de la biblioteca de Caltech y Harry B. Gray, en nombre de los autores.
