Fall: Ein 73-jähriger Mann mit einer Vorgeschichte von Bluthochdruck, koronarer Herzkrankheit und früherem Myokard Infarkt (MI) tritt bei der Notaufnahme (ED) mit Müdigkeit, Atemnot, vermindertem Urinausstoß und Knöchelschwellung auf. Bei seiner Ankunft gehören zu seinen Vitalfunktionen BP 87/58 mm Hg, HR 102, RR 24, T-Sättigung 86% an der Raumluft und Temperatur 98,2 F, und er hat Knistern bei der Auskultation. Wie würden Sie mit diesem Patienten umgehen?
Was ist ein kardiogener Schock?
Obwohl die Definitionen variieren, ist der kardiogene Schock (CS) eine klinische Diagnose, die allgemein als Zustand mit niedrigem Herzzeitvolumen und damit verbundenem Zustand definiert wird unzureichende Endorganperfusion oder Gewebehypoperfusion infolge einer Herzschädigung. 1 Häufig verwendete Kriterien aus der SHOCK-Studie bestehen aus Hypotonie (SBP < 90 mmHg oder > 90 mmHg mit unterstützender Sorgfalt), Nachweis von End- Organhypoperfusion und Herzindex (CI) < 2,2 l / min / m2 oder Lungenkapillarkeildruck ≥ 15 mmHg 2,3 Obwohl diese Definition nützlich ist, um Einschlusskriterien für klinische Studien zu standardisieren ist es weniger wertvoll für die Diagnose von CS in der Notaufnahme (ED). Bei Schichtwechsel in einer vielbeschäftigten ED kann die Diagnose von CS aufgrund der unterschiedlichen Erscheinungsformen, der Überschneidung mit anderen Schockzuständen (dh Sepsis), der schlecht verstandenen Pathophysiologie, der komplexen und multifaktoriellen Ursachen und der unterschiedlichen hämodynamischen Parameter schwierig sein.4 Ohne invasives Herzzeitvolumen (CO) – und PCWP-Werte, CS können unter Verwendung von Hinweisen auf erhöhte Fülldrücke (dh Lungenstauung oder erhöhte JVP), klinische Anzeichen einer Hypoperfusion und eine Vorgeschichte und ein Echo, die auf ein Herzversagen hindeuten, abgeleitet werden. Die sekundäre Mortalität nach CS ist hoch (~ 25-70%), aber Früherkennung und Intervention verbessern das Überleben.4,5 Notärzte haben die Möglichkeit, CS bei Aufnahme zu diagnostizieren, und müssen einen hohen klinischen Verdacht aufrechterhalten, wenn sie einen kritisch kranken Patienten sehen. Diese Überprüfung konzentriert sich auf die Erkennung und auf Tipps, wie Sie die Diagnose von CS durch körperliche Untersuchung, Labore, Ultraschall am Krankenbett und Bildgebung nicht verpassen können.
Was sind die Ursachen für kardiogenen Schock?
Die meisten CS-Studien konzentrieren sich auf Patienten mit CS infolge von Myokardinfarkten (MIs), an denen der linke Ventrikel beteiligt ist. Obwohl MIs die Hauptursache für CS sind (~ 70%), muss jede Ursache für ventrikuläre Dysfunktion und reduzierten CO oder Herzindex (CO / Körperoberfläche) als mögliche Ursache berücksichtigt werden.6 Dies umfasst, ist aber nicht beschränkt auf: Nichtischämische Ursachen für Rechtsherzinsuffizienz, Myokarditis, Takotsubo-Kardiomyopathie, hypertrophe Kardiomyopathie oder Herzklappenerkrankung (Tabelle 1). Um die Dinge schwieriger zu machen, ist CS eher ein Kontinuum als ein statischer Zustand, der von einer Verschlechterung der Herzinsuffizienz bis zu einem refraktären Schock mit irreversiblem Endorganschaden reicht (Abbildung 1). CS wird mit dem Auftreten von sekundären Beleidigungen wie Arrhythmien oder fortschreitender Ischämie und Azidose noch variabler.3 Es sollte beachtet werden, dass CS in 2/3 der Fälle bei der Aufnahme nicht vorhanden ist, sich aber später innerhalb von 48 Stunden nach dem Krankenhausaufenthalt als Patient entwickelt Das Kontinuum des Schocks wird weiterentwickelt.7 Es ist wichtig, die Vitalfunktionen, Symptome, körperlichen Untersuchungen und das Echo am Krankenbett des Patienten häufig neu zu bewerten.

Tabelle 1: Ursachen von CS, angepasst an Parrillo & Dellinger (2013) .8 70% der CS-Fälle werden durch akute MI verursacht.6 Auswirkungen eines akuten MI mit assoziierten Prozentsätze aus den Ergebnissen des SHOCK-Versuchsregisters.9.10
Abbildung 1: Kontinuum von CS, angepasst von Bellumkonda et al . (2018) .3 Dieses Spektrum kann mit sekundären Beleidigungen (z. B. neuen Arrhythmien) abweichen.
Mortalität bei kardiogenem Schock
Obwohl die sekundäre Mortalität nach CS hoch bleibt, 4 Früherkennung und Intervention verbessert das Überleben.5 Unter Verwendung von Daten, die das SHOCK-Studienregister enthielten, betrug die 30-Tage-Mortalität im Krankenhaus von 1.217 Patienten, bei denen aufgrund eines akuten MI ein CS als Folge eines Versagens des linken Ventrikels (LV) oder des rechten Ventrikels (RV) diagnostiziert wurde, 57% . Wenn Sie mehrere Risikofaktoren berücksichtigen, insbesondere Schock bei Aufnahme, Alter, frühere Bypass-Transplantation der Koronararterien (CABG), nicht minderwertiger MI, Kreatinin > 1,9 mg / dl, verringerter SBP, anoxisch Hirnverletzungen und klinische Hinweise auf eine Hypoperfusion des Endorgans konnten in Patienten mit einer Mortalität zwischen 12% und 88% unterteilt werden.11 In der GRACE-Studie nahm die CS zwischen 1999 und 2006 schwach, aber signifikant ab, wahrscheinlich aufgrund des vermehrten Einsatzes von Perkutan Koronarintervention (PCI), eine wichtige Form der Frühintervention bei Patienten mit MI, die durch CS.12 kompliziert wird. Selbst wenn Patienten anhand von Risikofaktoren geschichtet wurden, kamen PCI und CABG sowohl Patienten mit niedrigem als auch mit hohem Risiko zugute.11 Eine frühzeitige Diagnose und angemessene Behandlung, insbesondere bei Myokardischämie, bleibt ein wichtiger veränderbarer Faktor für die Ergebnisse bei Patienten mit CS.
Je länger die CS fortschreitet, desto wahrscheinlicher ist eine maladaptive Entzündung Reaktion sekundär zu einem Anstieg von Zytokinen wie TNF-alpha und IL-6, die die Herzaktivität hemmen. 4,13 Es gibt auch einen Anstieg von Vasopressin und Angiotensin II, der die Nachlast erhöht, das CO verschlechtert und die Wasser- und Salzretention erhöht, wodurch Lungenödeme verursacht werden. Stickstoffmonoxid (NO) wird auch durch die Aktivierung der NO-Synthase erhöht, was zu Vasodilatation und Myokarddepression führt. Alle diese Fehlanpassungsreaktionen auf niedrige CO- und Myokardischämie führen zu einer Verschlechterung der Schädigung des Herzgewebes, einer Senkung des CO und einem Verteilungsschock. Es sollte beachtet werden, dass einige Fälle von CS iatrogen sind, wenn Patienten am Rande einer Herzinsuffizienz mit aggressiven Diuretika, Nitraten, Betablockern, ACEI und Morphin behandelt werden. 14 Daher müssen Notärzte als erster Arzt, der Patienten bewertet, CS zeitkritisch und klinisch angemessen identifizieren und behandeln.
Klinische Bewertung
Klassisch Patienten mit CS bei Beschwerden über Atemnot, Brustschmerzen, Müdigkeit und / oder Knöchelschwellung.15 Die körperliche Untersuchung kann Anzeichen einer Verstopfung einschließlich peripherer Ödeme, Jugularvenendehnung (JVD), Knistern / Rasseln bei Auskultation und Anzeichen einer Hypoperfusion wie Coolness aufzeigen. schlecht durchblutete Extremitäten (Tabelle 2). In einer kleinen retrospektiven Überprüfung von 30 Patienten mit undifferenziertem Schock hatten Patienten mit CS häufiger JVD (80% im Vergleich zu 0% und 20%), kalte Haut (57,1% im Vergleich zu 14,3% und 28,5%) und Lungenerkrankungen Rales (75% gegenüber 16,7% und 8,3%) im Vergleich zu Patienten mit verteilendem bzw. hypovolämischem Schock.16 In einer anderen prospektiven Studie mit 68 Patienten verwendeten die Bewohner spezifische klinische Untersuchungsergebnisse, um Kategorien von Schock zu unterscheiden. CS wurde nach SBP von weniger als 90, Anzeichen einer geringen Leistung (kalte Hände, schlechte Kapillarfüllung und schwacher Puls), erhöhtem Jugularvenendruck (JVP) > 7 cmH2O, S3-Galopp kategorisiert und knistert zu 1/3 der Lunge. Von 68 Patienten erfüllten 11 die Kriterien für CS. Bei Patienten mit echokardiographischem Nachweis eines niedrigen Herzzeitvolumens prognostizierte ein erhöhter JVP eine CS mit einer Genauigkeit von 80%, die beim Hinzufügen von Knistern unverändert blieb.17
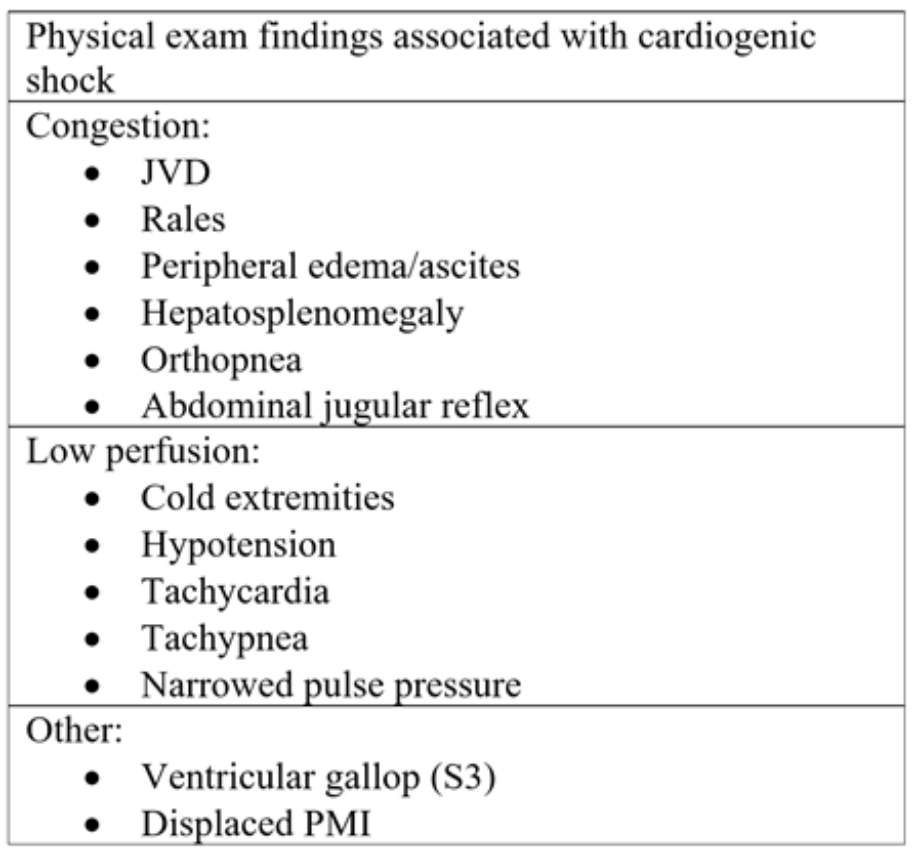
Tabelle 2: Komponenten der körperlichen Untersuchung bei akuter Herzinsuffizienz und anschließendem kardiogenem Schock.18
Obwohl JVP ein nützlicher Ersatz für erhöhten Keildruck ist 19, kann es schwierig sein, ihn zu bewerten Aufgrund des Habitus des Körpers und der Positionierung des Patienten (der Kopf des Bettes sollte um 45 Grad angehoben sein, was bei Patienten mit schwerer Orthopnoe schwierig sein kann) .20 Der JVP wird gemessen, indem der höchste Pulsationspunkt in cm über dem Sternalwinkel berechnet und dann 5 addiert wird (da das rechte Atrium 5 cm unter dem Sternalwinkel liegt), was mit der Ausdehnung in cmH20 korreliert (Abbildung 2). Erhöhte Werte werden oft als größer als 6-8 cmH20 angesehen.18 Bemerkenswerterweise ist ein erhöhter JVP mit einem erhöhten Mortalitätsrisiko verbunden, mit einem relativen Risiko (RR) von 1,52,18
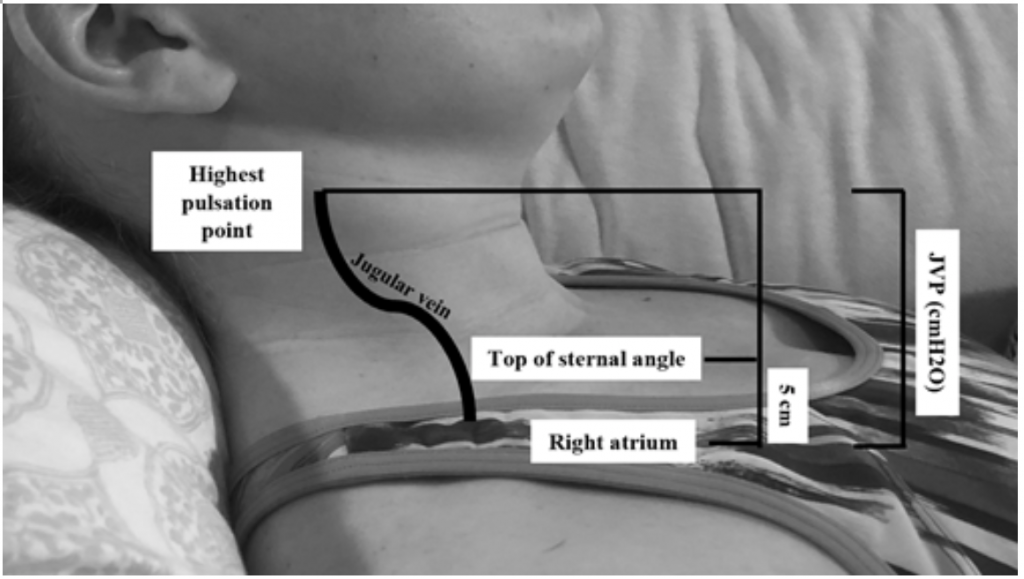
Abbildung 2: Messung der JVP, angepasst von Shah & Cowger (2014) .18
Labs können dies zeigen eine metabolische Azidose (wenn das Laktat aufgrund einer peripheren Ischämie zunimmt), eine Nierenhypoperfusion mit daraus resultierender akuter Nierenverletzung und mögliche Hinweise auf eine Herzischämie mit erhöhten Troponin- und EKG-Veränderungen.15 In der CardShock-Studie wurde eine multizentrische, prospektive Beobachtungsstudie mit 219 CS durchgeführt Patienten waren Laktatspiegel signifikant mit einer erhöhten Mortalität assoziiert (angepasstes Odds Ratio von 1,4) .6 Es ist wichtig zu beachten, dass die Laktaterhöhung nicht spezifisch für Sepsis ist und in jedem hypoperfundierten Zustand wie CS beobachtet werden kann.
Andererseits gelten diese Ergebnisse der körperlichen Untersuchung und die hämodynamischen Parameter nicht immer. In einer Studie unter Verwendung des SHOCK-Studienregisters hatten 5,2% der CS-Patienten keine offene Hypotonie, obwohl sie Anzeichen einer peripheren Hypoperfusion und eines niedrigen CI aufwiesen.21 Dies ist wahrscheinlich auf eine adaptive Katecholaminfreisetzung im frühen CS zurückzuführen, die den systemischen Gefäßwiderstand erhöht ( SVR) und hält den Blutdruck vorübergehend aufrecht, wenn auch im Allgemeinen mit einem engen Pulsdruck.22 Selbst bei Patienten mit klinisch signifikantem Lungenödem bei der Bildgebung können Keuchen oder sogar klare Lungengeräusche anstelle von Rales auftreten.23 In einer Studie wurde nur eine Lungenstauung beobachtet Ungefähr 2/3 Fälle von CS nach MI.21 Selbst bei verminderter LV-Kontraktilität können CS-Patienten möglicherweise keine schwerwiegende Verringerung des LVEF aufweisen. 14,24 Tatsächlich beträgt die mittlere EF in einer Kohorte von CS-Patienten etwa 30%, was reduziert, aber höher als erwartet ist.2
Obwohl die Untersuchung nicht perfekt ist, kann eine detaillierte körperliche Untersuchung, die nach Anzeichen von Stauung und peripherer Hypoperfusion sucht, sowie eine sorgfältige Überprüfung der Vitalfunktionen und Labore der erste Hinweis darauf sein, dass Ihr Patient einen kardiogenen Schock hat.
Point-of-Care-ECHO zur Bewertung des kardiogenen Schocks
Wenn Patienten mit ED blutdrucksenkend oder hypoperfundiert sind, ist die RUSH-Untersuchung eine schnelle Möglichkeit, den Schock anhand der Pumpe zu unterscheiden. der Tank und die Rohre. “25,26 Bei CS zeigt das transthorakale Echokardiogramm klassisch einen hypodynamischen, erweiterten LV mit schlechtem LV-Druck und der damit verbundenen unzureichenden Bewegung des vorderen Mitralklappenblatts während der Systole und Diastole (dh schlechte Kontraktilität). Die Schätzung der Ejektionsfraktion (EF) und des CO (als CO = Schlagvolumen (SV) x Herzfrequenz (HR)) durch einfaches „Augapfel“ -LV-Quetschen ist eine adäquate Beurteilung durch Ärzte im akuten Umfeld.27 Bei CS ist die Vena inferior Cava (IVC), eine indirekte Messung der effektiven intra Das Gefäßvolumen sollte einen Durchmesser von > 2 cm haben und kollabiert mit Inspiration zu weniger als 50%. Diese Befunde korrelieren mit einem erhöhten zentralvenösen Druck.28 Die IVC-Beurteilung kann jedoch ungenau sein, wenn der Patient bereits Vasodilatatoren, Diuretika erhalten und / oder beatmet wurde.29 Thoraxfenster zeigen wahrscheinlich Lungenödeme in Form von übermäßigem B. Linien („Lungenraketen“), die das Ergebnis einer Verdickung des Septums aufgrund von Wasseransammlungen im Interstitium sind.30 Bei einer RUSH-Untersuchung kann es bei der RUSH-Untersuchung zu Pleura- und Peritonealflüssigkeit kommen.25 In einer Metaanalyse wurden Daten aus drei Originalen verwendet In Veröffentlichungen und zwei Fallberichten wurde gezeigt, dass das RUSH-Protokoll sowohl sensitiv als auch spezifisch (0,89 bzw. 0,97) bei der Diagnose von CS.31 ist. Trotz eines hohen resultierenden positiven Wahrscheinlichkeitsverhältnisses (LR) von 22,29 gab es nur ein moderates Negativ Ein LR von 0,17, was darauf hindeutet, dass die RUSH-Prüfung nicht der perfekte Test ist, um CS auszuschließen. Daher sollte die RUSH-Prüfung im Rahmen einer sorgfältigen Anamnese und körperlichen Untersuchung verwendet werden und nicht allein zur Diagnose von Kardiogenen c Schock.
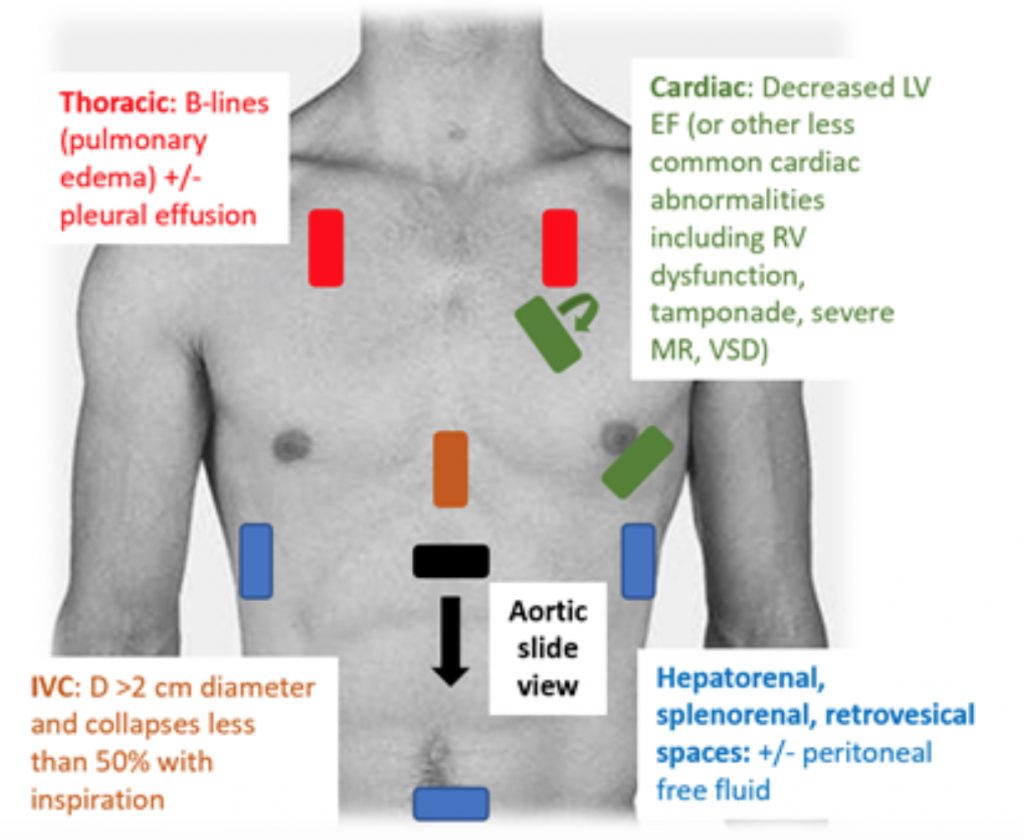
Abbildung 3: RUSH-US-Untersuchung am Krankenbett zur Bewertung der undifferenzierten Hypotonie mit assoziierten Befunden, die auf CS.25 hindeuten , 26,29,30
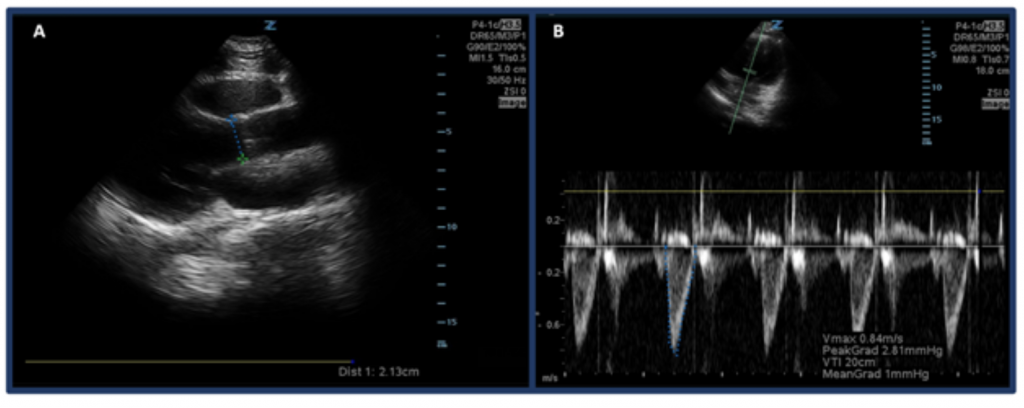
Anstatt CO nur durch „Augapfel“ zu schätzen, besteht eine Möglichkeit, CO mit Ultraschall zu messen, darin, zuerst SV unter Verwendung des Geschwindigkeitszeitintervalls des linksventrikulären Abflusstrakts (LVOT VTI oder der Geschwindigkeiten) zu bestimmen des Blutflusses am Aortenabflusstrakt) und des LVOT-Durchmessers. Insbesondere wird SV oder die Blutmenge, die pro Schlag durch den linken Ventrikel ausgestoßen wird, durch LVOT VTI × Querschnittsfläche des LVOT berechnet .32 Um den LVOT-Durchmesser zu messen, platzieren Sie die Phased-Array-Sonde in der parasternalen Längsachsenansicht und messen Sie die Abstand des LVOT direkt über der Aortenklappe in der Mitte der Systole. Der VTI wird in der Apikal-5-Kammer-Ansicht gemessen. Unter Verwendung des Pulswellen-Doppler-Modus wird die Doppler-Welle direkt über der Aortenklappe platziert und Doppler-Wellenformen werden aufgezeichnet. Stellen Sie sicher, dass die Achse so gut wie möglich mit dem Abflusstrakt ausgerichtet ist, um Über- / Unterschätzungen zu vermeiden. Messen Sie nach Auswahl des Messwerkzeugs „LVOT VTI“ die Wellenform einer Ausstoßperiode.33,34 Der normale LVOT VTI liegt zwischen 18 und 22 cm, ist jedoch möglicherweise niedriger bei HRs > 95 bpm. 35 Bei Patienten mit Vorhofflimmern werden VTI-Messungen wahrscheinlich den wahren Wert unterschätzen, und daher wird ein Durchschnitt von 3-5 aufeinanderfolgenden Wellenformen vorgeschlagen. Wie zu erwarten ist, besteht eine Korrelation zwischen niedrigem LVOT-VTI und unerwünschten Ergebnissen.32
Empfohlener Bewertungspfad
Wie oben erläutert, gibt es keinen einzigen Untersuchungsbefund oder Labortest, der eine Diagnose stellen kann CS. Wenn daher ein hoher Verdacht auf CS bei Hypotonie oder Anzeichen einer Hypoperfusion besteht, empfehlen wir die Verwendung von Anamnese, detaillierter körperlicher Untersuchung, US-Patienten am Krankenbett, Labors (insbesondere Kreatinin, Laktat, Troponin, BNP und anderen Hypoperfusionsmarkern) / Endorganschaden) und EKG (da akuter MI die Hauptursache für CS und Anzeichen von Ischämie ist und möglicherweise ein Auftreten erforderlich macht Revaskularisation) zur Unterstützung der Diagnose (siehe Abbildung 5). Betrachten Sie einen arteriellen Katheter-Monitor für den Blutdruck und leiten Sie die Behandlung. Über eine gezielte Herz- und Lungenuntersuchung hinaus sollte sich die körperliche Untersuchung auf JVD und Extremitätenperfusion konzentrieren. Die oben diskutierte RUSH-Prüfung und Berechnung von EF / CO / CI durch LVOT-VTI-Messungen sind wertvolle Ergänzungen zur Bewertung. Die Verwendung eines umfassenden Ansatzes zur Bewertung von CS wird ein besseres Verständnis dieser heterogenen Krankheit schaffen und das Management unterstützen.
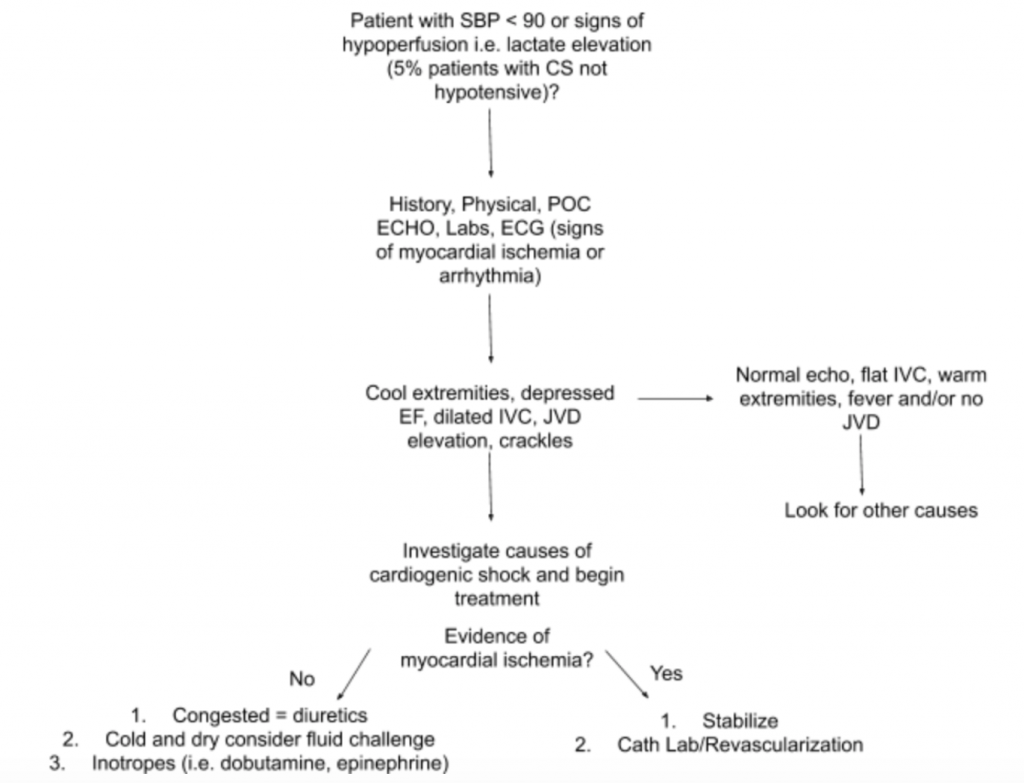
Schlussfolgerung : Bei weiterer Untersuchung wird der juguläre Venendruck des Patienten auf 10 cmH20 erhöht, und seine Füße sind kühl mit verzögerter Kapillarfüllung. Die RUSH-Untersuchung am Krankenbett zeigt ein bilaterales diffuses Lungenödem und eine geschätzte niedrige EF.Der LVOT VTI wird nur bei 10 cm gemessen. Das EKG zeigt ST-Erhöhungen in den präkordialen Ableitungen. Laktat und Troponin sind leicht erhöht. Der Patient wird durch eine kurze Studie mit Dobutamin, IV-Furosemid und CPAP mit mäßiger Verbesserung der Vitalwerte und des Atemstatus stabilisiert und anschließend zur Entstehung einer PCI an das Katheterlabor geschickt.
Take-Home-Punkte:
- CS wird hauptsächlich durch einen akuten MI (~ 70%) verursacht und steht im Mittelpunkt der meisten Studien, es sollten jedoch auch andere Ursachen berücksichtigt werden (siehe vollständige Liste in Abbildung 1).
- Die Mortalität nach CS bleibt hoch (~ 60%), obwohl eine frühzeitige Identifizierung und Intervention das Überleben verbessert.
- Führen Sie eine sorgfältige körperliche Untersuchung durch, um nach Hypoperfusion zu suchen Überlastung. JVP ist eine wichtige Komponente der körperlichen Untersuchung für die Diagnose von CS und geht mit einer erhöhten Mortalität einher (RR = 1,52).
- Die RUSH-Untersuchung ist sowohl sensitiv als auch spezifisch (0,89 bzw. 0,97) bei der Diagnose von CS. Ultraschall am Krankenbett sollte häufig wiederholt werden, da die meisten Patienten anfangs nicht an CS teilnehmen.
- Die Verwendung von LVOT VTI ist eine einfache und nicht-invasive Methode zur Bewertung von CO mit geringen Messungen, die mit unerwünschten Ergebnissen verbunden sind.
- Ein vorgeschlagener Ansatz zur Bewertung von Patienten mit Verdacht auf CS mit Schwerpunkt auf ihrer heterogenen Pathologie und Darstellung ist in Abbildung 5 zusammengefasst.
FOAMed-Ressourcen:
- EM in 5 : Schock
- emDocs: Kardiogener Schock
- emDocs: ED-Management von Herzinsuffizienz – Perlen und Fallstricke
- emDocs: RUSH-Protokoll („Rapid Ultrasound for Shock“)
- emDocs: Der hypotensive ED-Patient: Ein sequentieller systematischer Ansatz
- Erste 10 EM: Undifferenzierte Hypotonie
