Obwohl alle Atome eines Elements die gleiche Anzahl von Protonen haben, können sich die Atome in der Anzahl der Neutronen unterscheiden (Tabelle 1-2). Diese unterschiedlichen Atome desselben Elements werden Isotope genannt. Vier Helotisotope (He) sind in Abbildung 1-1 dargestellt. Alle Chloratome (Cl) haben 17 Protonen, aber es gibt Chlorisotope mit 15 bis 23 Neutronen. In der Natur existieren nur zwei Chlorisotope in signifikanten Mengen, solche mit 18 Neutronen (75,53% aller in der Natur vorkommenden Chloratome) und solche mit 20 Neutronen (24,47%). Um das Symbol für ein Isotop zu schreiben, platzieren Sie die Ordnungszahl als Index und die Massenzahl (Protonen plus Neutronen) als hochgestellt links vom Atomsymbol. Die Symbole für die beiden natürlich vorkommenden Chlorisotope wären dann  Cl und
Cl und 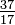 Cl. Genau genommen ist der Index nicht erforderlich, da alle Chloratome 17 Protonen haben. Daher werden die Isotopensymbole normalerweise ohne den Index 35Cl und 37Cl geschrieben. Bei der Diskussion dieser Isotope verwenden wir die. Begriffe Chlor-35 und Chlor-37. Damit ein Kern stabil ist, sollte die Anzahl der Neutronen (für die ersten Elemente) gleich oder geringfügig über der Anzahl der Protonen liegen. Je mehr Protonen vorhanden sind, desto größer ist das Verhältnis von Neutronen zu Protonen, um die Stabilität zu gewährleisten. Kerne, die zu viele der beiden Arten von Grundpartikeln aufweisen, sind instabil und zerfallen radioaktiv auf eine Weise, die in Kapitel 23 beschrieben wird.
Cl. Genau genommen ist der Index nicht erforderlich, da alle Chloratome 17 Protonen haben. Daher werden die Isotopensymbole normalerweise ohne den Index 35Cl und 37Cl geschrieben. Bei der Diskussion dieser Isotope verwenden wir die. Begriffe Chlor-35 und Chlor-37. Damit ein Kern stabil ist, sollte die Anzahl der Neutronen (für die ersten Elemente) gleich oder geringfügig über der Anzahl der Protonen liegen. Je mehr Protonen vorhanden sind, desto größer ist das Verhältnis von Neutronen zu Protonen, um die Stabilität zu gewährleisten. Kerne, die zu viele der beiden Arten von Grundpartikeln aufweisen, sind instabil und zerfallen radioaktiv auf eine Weise, die in Kapitel 23 beschrieben wird.

Beispiel 1.2.1
Wie viele Protonen, Neutronen und Elektronen befinden sich dort? ein Atom des stabilsten Isotops von Uran, Uran-238? Schreiben Sie das Symbol für dieses Isotop. Siehe Abbildung. 1-1.
Lösung
Die Ordnungszahl von Uran (siehe die innere hintere Abdeckung) beträgt 92, und die Massenzahl des Isotops wird mit 238 angegeben. Daher hat es 92 Protonen, 92 Elektronen und 238 – 92 = 146 Neutronen. Sein Symbol ist  U (oder 238U).
U (oder 238U).
Die Gesamtmasse eines Atoms wird als Atomgewicht bezeichnet, und dies ist fast, aber nicht genau die Summe der Massen seiner Bestandteile Protonen, Neutronen und Elektronen. * Wenn sich Protonen, Neutronen und Elektronen zu einem Atom verbinden, wird ein Teil ihrer Masse in Energie umgewandelt und abgegeben. (Dies ist die Energiequelle bei Kernfusionsreaktionen.) Da das Atom nur dann in seine Grundpartikel zerlegt werden kann, wenn die Energie für die fehlende Masse von außerhalb geliefert wird, wird diese Energie als Bindungsenergie des Kerns bezeichnet.
Hinweis: Atomgewicht vs. Atommasse
Die Begriffe Atomgewicht und Molekulargewicht werden von arbeitenden Wissenschaftlern allgemein verwendet und werden in diesem Buch verwendet, auch wenn diese technisch sind Massen statt Gewichte.
| Elektronen | Protonen | Neutronen |
Atom Anzahl |
Atomgewicht (amu) |
Gesamtladung (Elektroneneinheiten) |
|
|---|---|---|---|---|---|---|
| Wasserstoffatom, 1H oder H | 1 | 1 | 0 | 1 | 1,008 | 0 |
| Deuteriumatom, 2H oder D | 1 | 1 | 1 | 1 | 2,014 | 0 |
| Tritiumatom, 3H oder T | 1 | 1 | 2 | 1 | 3.016 | 0 |
| Wasserstoffion, H + | 0 | 1 | 0 | 1 | 1,007 | +1 |
| Heliumatom, 4He | 2 | 2 | 2 | 2 | 4.003 | 0 |
| Heliumkern oder Alpha-Partikel, He2 + oder α | 0 | 2 | 2 | 2 | 4.002 | +2 |
| Lithiumatom, 7Li | 3 | 3 | 4 | 3 | 7.016 | 0 |
| Kohlenstoffatom, 12Ca | 6 | 6 | 6 | 6 | 12.000 | 0 |
| Sauerstoffatom, 16O | 8 | 8 | 8 | 8 | 15.995 | 0 |
| Chloratom, 35Cl | 17 | 17 | 18 | 17 | 34.969 | 0 |
| Chloratom, 37Cl | 17 | 17 | 20 | 17 | 36.966 | 0 |
| Natürlich vorkommende Mischung von Chlor | 17 | 17 | 18 oder 20 | 17 | 35.453 | 0 |
| Uranatom, 234U | 92 | 92 | 142 | 92 | 234.04 | 0 |
| Uranatom, 235U | 92 | 92 | 143 | 92 | 235.04 | 0 |
| Uranatom, 238U | 92 | 92 | 146 | 92 | 238.05 | 0 |
| Natürlich vorkommende Mischung aus Uran | 92 | 92 | variierte | 92 | 238.03 | 0 |
Beispiel 1.2. 2
Berechnen Sie die Masse, die verloren geht, wenn ein Atom aus Kohlenstoff-12 aus Protonen, Elektronen und Neutronen gebildet wird.
Lösung
Seit dem Atomnu Die Zahl jedes Kohlenstoffatoms beträgt 6, Kohlenstoff-12 hat 6 Protonen und damit 6 Elektronen. Um die Anzahl der Neutronen zu ermitteln, subtrahieren wir die Anzahl der Protonen von der Massenzahl: 12 – 6 = 6 Neutronen. Wir können die Daten in Tabelle 1-1 verwenden, um die Gesamtmasse dieser Partikel zu berechnen:
| Protonen: | 6 x 1,00728 amu = 6,04368 amu |
| Neutronen: | 6 x 1,00867 amu = 6,05202 amu |
| Elektronen: | 6 X 0,00055 amu = 0,00330 amu |
| Gesamtpartikelmasse: 12,09900 amu |
Nach der Definition der Skala der Atommasseneinheiten beträgt die Masse eines Kohlenstoff-12-Atoms genau 12 amu. Daher sind 0,0990 amu Masse beim Aufbau des Atoms aus seinen Partikeln verschwunden.
Beispiel 1.2.3
Berechnen Sie das erwartete Atomgewicht des Chlorisotop mit 20 Neutronen. Vergleichen Sie dies mit dem tatsächlichen Atomgewicht dieses Isotops, wie in Tabelle 1-2 angegeben.
Lösung
Das Chlorisotop hat 17 Protonen und 20 Neutronen:
| Protonen: | 17 x 1,00728 amu = | 17.1238 amu |
| Neutronen: | 20 x 1,00867 amu = | 20.1734 amu |
| Elektronen: | 17 x 0,00055 amu = | 0,0094 amu |
| Gesamtpartikelmasse: | 37.3066 amu | |
| Tatsächlich beobachtetes Atomgewicht: | 36.966 amu | |
| Massenverlust: | 0,341 amu |
Jedes Isotop eines Elements ist durch eine Ordnungszahl (Gesamtzahl der Protonen), eine Massenzahl (Gesamtzahl der Protonen) gekennzeichnet s und Neutronen) und ein Atomgewicht (Atommasse in Atommasseneinheiten). Da die Massenverluste bei der Bildung eines Atoms gering sind, entspricht die Massenzahl normalerweise dem auf die nächste ganze Zahl gerundeten Atomgewicht. (Zum Beispiel beträgt das Atomgewicht von Chlor-37 36,966, was auf 37 gerundet ist.) Wenn es mehrere Isotope eines Elements in der Natur gibt, wird natürlich das experimentell beobachtete Atomgewicht (das natürliche Atomgewicht) gewichtet Durchschnitt der Isotopengewichte. Der Durchschnitt wird nach der prozentualen Häufigkeit der Isotope gewichtet. Chlor kommt in der Natur als 75,53% Chlor-35 (34,97 amu) und 24,47% Chlor-37 (36,97 amu) vor, so dass der gewichtete Durchschnitt der Isotopengewichte
\
beträgt Atomgewichte auf der Rückseite dieses Buches sind alle gewichteten Durchschnittswerte der in der Natur vorkommenden Isotope, und dies sind die Zahlen, die wir fortan verwenden werden – es sei denn, wir diskutieren speziell ein Isotop. Alle Isotope eines Elements verhalten sich chemisch größtenteils gleich. Ihr Verhalten unterscheidet sich in Bezug auf massenempfindliche Eigenschaften wie Diffusionsraten, auf die wir später in diesem Buch noch eingehen werden.
Beispiel 1.2.4
Magnesium ( Mg) hat drei signifikante natürliche Isotope: 78,70% aller Magnesiumatome haben ein Atomgewicht von 23,985 amu, 10,13% haben ein Atomgewicht von 24,986 amu und 11,17% haben ein Atomgewicht von 25,983 amu. Wie viele Protonen und Neutronen sind vorhanden Wie schreiben wir die Symbole für jedes Isotop? Wie hoch ist schließlich der gewichtete Durchschnitt der Atomgewichte?
Lösung
Insgesamt gibt es 12 Protonen Magnesiumisotope. Das Isotop mit einem Atomgewicht von 23.985 amu hat eine Massenzahl von 24 (Protonen und Neutronen), also ergeben 24 – 12 Protonen 12 Neutronen. Das Symbol für dieses Isotop ist 24 mg. Ebenso das Isotop mit einem Atomgewicht von 24.986 amu hat eine Massenzahl von 25, 13 Neutronen und 25 mg als Symbol. Das dritte Isotop (25.983 amu) hat eine Massenzahl von 26, 14 Neutronen und 26 mg als Symbol. Wir berechnen das durchschnittliche Atomgewicht wie folgt:
(0,7870 x 23,985) + (0,1013 x 24,986) + (0,1117 x 25,983) = 24,31 amu
Beispiel 1.2.5
Bor hat zwei natürlich vorkommende Isotope, lOB und 11B. Wir wissen, dass 80,22% seiner Atome 11B sind, Atomgewicht 11.009 amu. Berechnen Sie aus dem natürlichen Atomgewicht auf der Innenseite der Rückseite das Atomgewicht des lOB-Isotops.
Lösung
Wenn 80,22% aller Boratome 11B sind, dann 100,00 – 80,22 oder 19,78% sind das unbekannte Isotop. Wir können W verwenden, um das unbekannte Atomgewicht in unserer Berechnung darzustellen:
(0,8022 x 11,009) + (0,1978 x W) = 10,81 amu (natürliches Atomgewicht) W =  = 10.01 amu
= 10.01 amu
Mitwirkende und Zuschreibungen
-
R. E. Dickerson, HB Gray, und GP Haight, Jr. Der Inhalt wurde aus „Chemical Principles“ verwendet, einem Einführungstext für allgemeine Chemie auf College-Ebene mit Genehmigung der Caltech-Bibliothek und von Harry B. Gray im Auftrag der Autoren / p>
