Det här är mina anteckningar från föreläsning 15 i Harvard’s Chemistry 20: Organic Chemistry-kurs, levererad av Dr. Ryan Spoering den 6 mars 2015.
Optisk rotation
Det faktum att enantiomerer roterar differentiellt polariserat ljus är en användbar egenskap för att bestämma sammansättningen av en blandning, som kan vara någonstans mellan racemisk (50/50) och ren (alla en enantiomer).
För kirala molekyler kan du slå upp ett värde som kallas 20D. 20D betyder rotation vid 20 ° C, med en banlängd på 1 dm, under ett natriumljus där λ = 581 nm (natrium D-linjen, därav D). Denna kvantitet, tillsammans med parametrarna c = koncentration i g / ml och l = väglängd, gör att du kan härleda den faktiska rotationen α på grund av ekvationen 20D = α / (cl).
| förhållande | α | ee |
|---|---|---|
| 100: 0 | +12 | 100% |
| 90:10 | +9,6 | 80% |
| 50:50 | 0 | 0% |
Observera att i en 90:10-blandning avlägsnas 10 av 10 av 90, så att du bara hamnar med 80% av den rotation du skulle ha i 100: 0-blandningen, för en 80 % ee.
Pasteur och vinsyra
År 1848 studerade Pasteur två till synes besläktade ämnen, vinsyra och raceminsyra. Vinsyra är en naturlig substans som ibland kristalliserar ur vin och är dextrorotär. Raceminsyra var en industriell biprodukt som i alla avseenden verkade identisk med vinsyra, förutom att den inte hade någon optisk rotation. Pasteur var en vitalist och var mycket intresserad av att belysa den fysiska grunden för vad som skiljer liv från icke-liv. Han misstänkte att optisk rotation var specifik för vital kraft, eftersom många naturprodukter var optiskt aktiva, medan syntetiska produkter nästan aldrig var.
Pasteur syntetiserade raceminsyra av natriumammonium och kristalliserade den sedan. Det bildade en hög med två olika typer av kristaller, som var makroskopiskt distinkta. Med en pincett och ett primitivt mikroskop från 1848 kunde du faktiskt plocka isär högen i två separata högar med kristaller, som var makroskopiska spegelbilder av varandra. Om du sedan löser upp de två pålarna, skulle de vara optiskt aktiva, men i motsatta riktningar.
Vi vet nu att väldigt få racemiska blandningar beter sig på detta sätt. De allra flesta kommer att bilda en rasemisk kristall; bara en handfull bildar separata kristaller. Dessutom, även om vi vet detta, är det faktiskt ganska svårt att återge Pasteurs experiment.
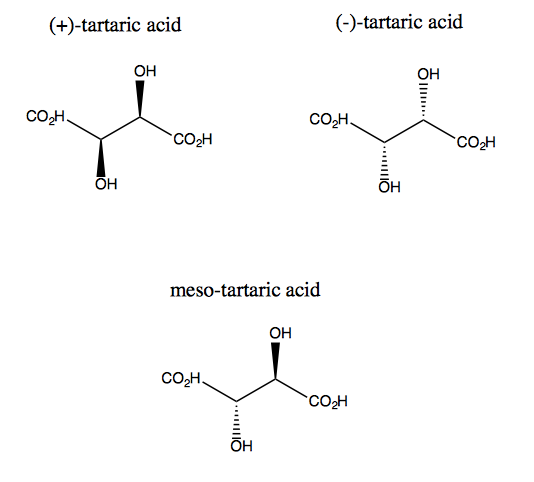
Vinsyra och dess enantiomer saknar plan symmetri, även om de båda har tvåfaldig rotationssymmetri. Det finns inget plan över vilket du kan reflektera vinsyra och ändå lägga det över. Således är molekylen kiral. Men om du föreställer dig att z-axeln sticker ut från skärmen kan du rotera molekylen 180 ° runt den axeln och sedan lägga den över. Detta kallas C2-symmetri. Vinsyra har också en diastereomer som kallas meso-vinsyra. Denna molekyl har ett symmetriplan och är därför achiral. I allmänhet kallas vilken förening som helst som har stereogena kol men också ett symmetriplan en mesoförening.
Stereospecificitet i syntes
Det finns tre huvudstrategier för att förbereda en enda enantiomer. Idag diskuterar vi ett berömt exempel som berör två av dessa tre metoder:
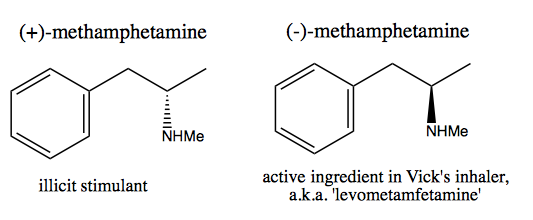
Folket, som Walter White , som vill syntetisera ren dextrometamfetamin för kommersiell försäljning, har utvecklat två metoder: kiral pool och upplösning.
Chiral pool
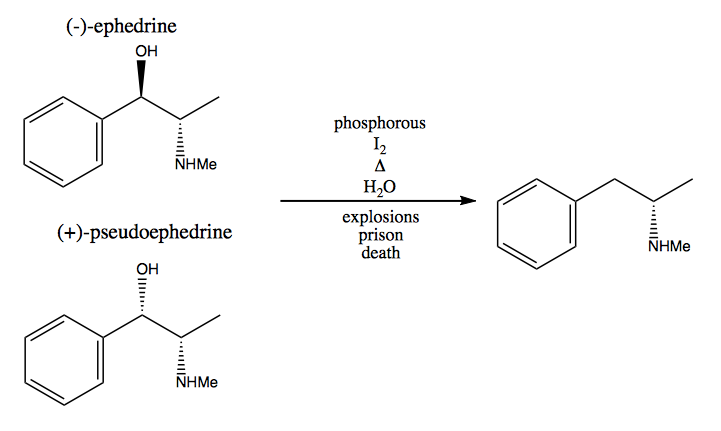
I chiral pool-metoden stjäl du stereogena centra från naturen. Naturen ger oss en enorm pool av kirala molekyler som vi kan använda som utgångsmaterial. När det gäller dextrometamfetamin kan du börja från (-) – efedrin eller (+) – pseudoefedrin och ta bort hydroxylgruppen via en mycket farlig reaktion:
Resolution
Eftersom narkotikabekämpningsinsatser har gjort det svårare och svårare att skaffa stora mängder pseudoefedrin har människor vänt sig mer mot resolutionsmetoden. I den här metoden syntetiserar du först en racemisk blandning:
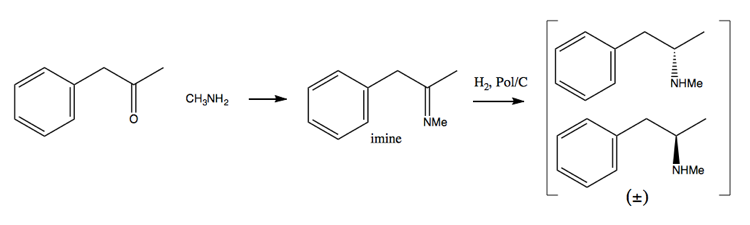
Sedan separerar du den genom att lägga till en enantiopure molekyl som (+ )-vinsyra. (+) – vinsyra bildar salter med varje enantiomer, men de två salterna har olika fysiska egenskaper, så under noggranna förhållanden kan du bara få ut dextrometamfetamin att kristallisera.
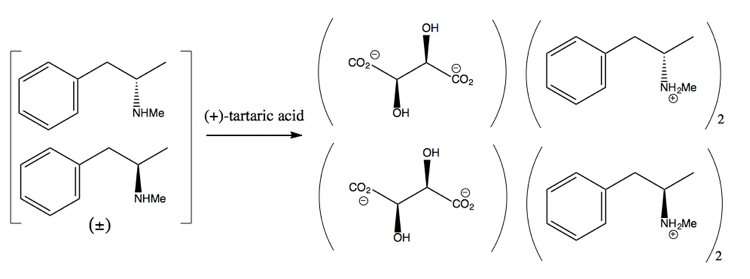
Detta är dock slösaktigt, eftersom du i bästa fall får 50% avkastning och i praktiken är det svårt att få ens så mycket.
Chiralitet utan stereogent kol
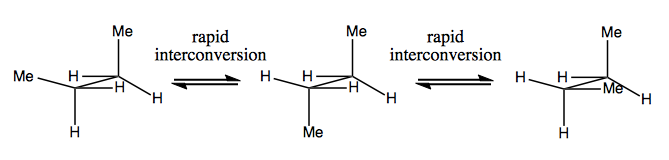
Nästa gång diskuterar vi molekyler som har chiralitet utan stereogent kol. Dessa är vanligtvis inte stabila och konverterar ganska snabbt. Här är ett exempel med ett stereogent kväve:
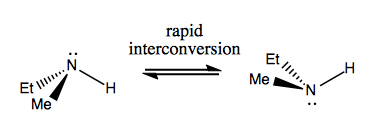
Det finns också konstiga exempel där en molekyl ännu inte har något enda stereogent centrum lyckas vara chiral totalt sett. Till exempel har Gauche butan axiell kiralitet även om inget kol är stereogent. Den interkonverterar också snabbt: