Sebbene tutti gli atomi di un elemento abbiano lo stesso numero di protoni, gli atomi possono differire nel numero di neutroni che hanno (Tabella 1-2). Questi diversi atomi dello stesso elemento sono chiamati isotopi. La Figura 1-1 mostra quattro isotopi dell’elio (He). Tutti gli atomi di cloro (Cl) hanno 17 protoni, ma ci sono isotopi di cloro aventi da 15 a 23 neutroni. In natura esistono solo due isotopi del cloro in quantità significative, quelli con 18 neutroni (75,53% di tutti gli atomi di cloro trovati in natura) e quelli con 20 neutroni (24,47%). Per scrivere il simbolo di un isotopo, posizionare il numero atomico come pedice e il numero di massa (protoni più neutroni) come apice a sinistra del simbolo atomico. I simboli per i due isotopi del cloro presenti in natura allora sarebbero  Cl e
Cl e 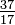 Cl. A rigor di termini, il pedice non è necessario, poiché tutti gli atomi di cloro hanno 17 protoni. Quindi i simboli degli isotopi sono solitamente scritti senza il pedice: 35Cl e 37Cl. Nel discutere questi isotopi, usiamo il. termini cloro-35 e cloro-37. Perché un nucleo sia stabile, il numero di neutroni dovrebbe (per i primi pochi elementi) essere uguale o leggermente superiore al numero di protoni. Più protoni, maggiore è il rapporto tra neutroni e protoni per garantire la stabilità. I nuclei che hanno troppe particelle fondamentali di entrambi i tipi sono instabili e si decompongono radioattivamente nei modi discussi nel Capitolo 23.
Cl. A rigor di termini, il pedice non è necessario, poiché tutti gli atomi di cloro hanno 17 protoni. Quindi i simboli degli isotopi sono solitamente scritti senza il pedice: 35Cl e 37Cl. Nel discutere questi isotopi, usiamo il. termini cloro-35 e cloro-37. Perché un nucleo sia stabile, il numero di neutroni dovrebbe (per i primi pochi elementi) essere uguale o leggermente superiore al numero di protoni. Più protoni, maggiore è il rapporto tra neutroni e protoni per garantire la stabilità. I nuclei che hanno troppe particelle fondamentali di entrambi i tipi sono instabili e si decompongono radioattivamente nei modi discussi nel Capitolo 23.

Esempio 1.2.1
Quanti protoni, neutroni ed elettroni ci sono in un atomo dell’isotopo più stabile dell’uranio, l’uranio-238? Scrivi il simbolo di questo isotopo. Fare riferimento alla figura. 1-1.
Soluzione
Il numero atomico di uranio (vedere la quarta di copertina interna) è 92 e il numero di massa dell’isotopo è 238. Quindi ha 92 protoni, 92 elettroni e 238-92 = 146 neutroni. Il suo simbolo è  U (o 238U).
U (o 238U).
La massa totale di un atomo è chiamata il suo peso atomico, e questo è quasi ma non esattamente la somma delle masse dei suoi protoni, neutroni ed elettroni costituenti. * Quando protoni, neutroni ed elettroni si combinano per formare un atomo, parte della loro massa viene convertita in energia e viene emessa. (Questa è la fonte di energia nelle reazioni di fusione nucleare.) Poiché l’atomo non può essere scomposto nelle sue particelle fondamentali a meno che l’energia per la massa mancante non sia fornita dall’esterno, questa energia è chiamata energia di legame del nucleo.
Nota: peso atomico e massa atomica
I termini peso atomico e peso molecolare sono universalmente usati dagli scienziati che lavorano e saranno usati in questo libro, anche se tecnicamente masse anziché pesi.
| Elettroni | Protoni | Neutroni |
Atomico Numero |
Peso atomico (amu) |
Carica totale (unità di elettroni) |
|
|---|---|---|---|---|---|---|
| Atomo di idrogeno, 1H o H | 1 | 1 | 0 | 1 | 1.008 | 0 |
| Atomo di deuterio, 2H o D | 1 | 1 | 1 | 1 | 2.014 | 0 |
| Atomo di trizio, 3H o T | 1 | 1 | 2 | 1 | 3.016 | 0 |
| Ione idrogeno, H + | 0 | 1 | 0 | 1 | 1.007 | +1 |
| Atomo di elio, 4He | 2 | 2 | 2 | 2 | 4.003 | 0 |
| Nucleo di elio o particella alfa, He2 + o α | 0 | 2 | 2 | 2 | 4,002 | +2 |
| Atomo di litio, 7Li | 3 | 3 | 4 | 3 | 7.016 | 0 |
| Atomo di carbonio, 12Ca | 6 | 6 | 6 | 6 | 12.000 | 0 |
| Atomo di ossigeno, 16O | 8 | 8 | 8 | 8 | 15,995 | 0 |
| Atomo di cloro, 35Cl | 17 | 17 | 18 | 17 | 34.969 | 0 |
| Atomo di cloro, 37Cl | 17 | 17 | 20 | 17 | 36.966 | 0 |
| Miscela naturale di cloro | 17 | 17 | 18 o 20 | 17 | 35.453 | 0 |
| Atomo di uranio, 234U | 92 | 92 | 142 | 92 | 234,04 | 0 |
| Atomo di uranio, 235U | 92 | 92 | 143 | 92 | 235.04 | 0 |
| Atomo di uranio, 238U | 92 | 92 | 146 | 92 | 238,05 | 0 |
| Miscela naturale di uranio | 92 | 92 | varia | 92 | 238.03 | 0 |
Esempio 1.2. 2
Calcola la massa che si perde quando un atomo di carbonio-12 è formato da protoni, elettroni e neutroni.
Soluzione
Poiché il nu atomico mber di ogni atomo di carbonio è 6, il carbonio-12 ha 6 protoni e quindi 6 elettroni. Per trovare il numero di neutroni, sottraiamo il numero di protoni dal numero di massa: 12 – 6 = 6 neutroni. Possiamo utilizzare i dati nella Tabella 1-1 per calcolare la massa totale di queste particelle:
| Protoni: | 6 X 1.00728 amu = 6.04368 amu |
| Neutroni: | 6 X 1.00867 amu = 6.05202 amu |
| Elettroni: | 6 X 0,00055 amu = 0,00330 amu |
| Massa totale delle particelle: 12,09900 amu |
Ma secondo la definizione della scala delle unità di massa atomica, la massa di un atomo di carbonio-12 è esattamente 12 amu. Quindi 0,0990 amu di massa sono scomparsi nel processo di costruzione dell’atomo dalle sue particelle.
Esempio 1.2.3
Calcola il peso atomico atteso del isotopo del cloro che ha 20 neutroni. Confronta questo con il peso atomico effettivo di questo isotopo come indicato nella Tabella 1-2.
Soluzione
L’isotopo del cloro ha 17 protoni e 20 neutroni:
| Protoni: | 17 X 1.00728 amu = | 17.1238 amu |
| Neutroni: | 20 X 1.00867 amu = | 20,1734 amu |
| Elettroni: | 17 X 0,00055 amu = | 0,0094 amu |
| Massa totale delle particelle: | 37.3066 amu | |
| Peso atomico effettivo osservato: | 36,966 amu | |
| Perdita di massa: | 0,341 amu |
Ogni isotopo di un elemento è caratterizzato da un numero atomico (numero totale di protoni), un numero di massa (numero totale di protoni se neutroni) e un peso atomico (massa dell’atomo in unità di massa atomica). Poiché le perdite di massa durante la formazione di un atomo sono piccole, il numero di massa è solitamente lo stesso del peso atomico arrotondato all’intero più vicino. (Ad esempio, il peso atomico del cloro-37 è 36,966, che è arrotondato a 37.) Se ci sono diversi isotopi di un elemento in natura, allora ovviamente il peso atomico osservato sperimentalmente (il peso atomico naturale) sarà il peso media dei pesi degli isotopi. La media è ponderata in base all’abbondanza percentuale degli isotopi. Il cloro è presente in natura come 75,53% di cloro-35 (34,97 amu) e 24,47% di cloro-37 (36,97 amu), quindi la media ponderata dei pesi degli isotopi è
\
I pesi atomici riportati nella quarta di copertina di questo libro sono tutte le medie ponderate degli isotopi che si verificano in natura, e queste sono le cifre che useremo d’ora in poi, a meno che non stiamo discutendo specificamente di un isotopo. Tutti gli isotopi di un elemento si comportano chimicamente allo stesso modo per la maggior parte. Il loro comportamento sarà diverso per quanto riguarda le proprietà sensibili alla massa come i tassi di diffusione, che vedremo più avanti in questo libro.
Esempio 1.2.4
Magnesio ( Mg) ha tre isotopi naturali significativi: il 78,70% di tutti gli atomi di magnesio ha un peso atomico di 23,985 amu, il 10,13% ha un peso atomico di 24,986 amu e l’11,17% ha un peso atomico di 25,983 amu. Quanti protoni e neutroni sono presenti in ciascuno di questi tre isotopi? Come scriviamo i simboli per ogni isotopo? Infine, qual è la media ponderata dei pesi atomici?
Soluzione
Ci sono 12 protoni in tutto isotopi di magnesio. L’isotopo il cui peso atomico è 23,985 amu ha un numero di massa di 24 (protoni e neutroni), quindi 24-12 protoni danno 12 neutroni. Il simbolo di questo isotopo è 24 Mg. Allo stesso modo, l’isotopo il cui peso atomico è 24.986 amu ha un numero di massa di 25, 13 neutroni e 25Mg come simbolo. Il terzo isotopo (25,983 amu) ha un numero di massa di 26, 14 neutroni e 26 Mg come simbolo. Calcoliamo il peso atomico medio come segue:
(0,7870 X 23,985) + (0,1013 X 24,986) + (0,1117 X 25,983) = 24,31 amu
Esempio 1.2.5
Il boro ha due isotopi presenti in natura, lOB e 11B. Sappiamo che l’80,22% dei suoi atomi sono 11B, il peso atomico 11,009 amu. Calcolare il peso atomico dell’isotopo lOB dal peso atomico naturale indicato nella quarta di copertina.
Soluzione
Se l’80,22% di tutti gli atomi di boro è 11B, allora 100,00 – 80,22 , o 19,78%, sono l’isotopo sconosciuto. Possiamo usare W per rappresentare il peso atomico sconosciuto nel nostro calcolo:
(0,8022 X 11,009) + (0,1978 XW) = 10,81 amu (peso atomico naturale) W =  = 10.01 amu
= 10.01 amu
Contributori e attribuzioni
-
R. E. Dickerson, HB Gray e GP Haight, Jr. Il contenuto è stato utilizzato da “Chemical Principles”, un testo introduttivo a livello universitario per la chimica generale con il permesso della biblioteca Caltech e di Harry B. Gray, a nome degli autori.
