Bien que tous les atomes d’un élément aient le même nombre de protons, les atomes peuvent différer par le nombre de neutrons qu’ils ont (Tableau 1-2). Ces différents atomes du même élément sont appelés isotopes. Quatre isotopes de l’hélium (He) sont représentés sur la figure 1-1. Tous les atomes de chlore (Cl) ont 17 protons, mais il existe des isotopes de chlore ayant 15 à 23 neutrons. Seuls deux isotopes du chlore existent en quantités significatives dans la nature, ceux avec 18 neutrons (75,53% de tous les atomes de chlore trouvés dans la nature) et ceux avec 20 neutrons (24,47%). Pour écrire le symbole d’un isotope, placez le numéro atomique en indice et le numéro de masse (protons plus neutrons) en exposant à gauche du symbole atomique. Les symboles des deux isotopes naturels du chlore seraient alors  Cl et
Cl et 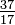 Cl. À proprement parler, l’indice n’est pas nécessaire, puisque tous les atomes de chlore ont 17 protons. Par conséquent, les symboles isotopiques sont généralement écrits sans l’indice: 35Cl et 37Cl. Pour discuter de ces isotopes, nous utilisons le. termes chlore-35 et chlore-37. Pour qu’un noyau soit stable, le nombre de neutrons doit (pour les premiers éléments) être égal ou légèrement supérieur au nombre de protons. Plus il y a de protons, plus le rapport neutrons / protons est grand pour assurer la stabilité. Les noyaux qui contiennent trop de l’un ou l’autre type de particule fondamentale sont instables et se décomposent radioactivement de la manière décrite au chapitre 23.
Cl. À proprement parler, l’indice n’est pas nécessaire, puisque tous les atomes de chlore ont 17 protons. Par conséquent, les symboles isotopiques sont généralement écrits sans l’indice: 35Cl et 37Cl. Pour discuter de ces isotopes, nous utilisons le. termes chlore-35 et chlore-37. Pour qu’un noyau soit stable, le nombre de neutrons doit (pour les premiers éléments) être égal ou légèrement supérieur au nombre de protons. Plus il y a de protons, plus le rapport neutrons / protons est grand pour assurer la stabilité. Les noyaux qui contiennent trop de l’un ou l’autre type de particule fondamentale sont instables et se décomposent radioactivement de la manière décrite au chapitre 23.

Exemple 1.2.1
Combien de protons, neutrons et électrons y a-t-il dans un atome de l’isotope le plus stable de l’uranium, l’uranium-238? Écrivez le symbole de cet isotope. Reportez-vous à la figure. 1-1.
Solution
Le numéro atomique de l’uranium (voir l’intérieur de la couverture arrière) est 92, et le numéro de masse de l’isotope est donné comme 238. Par conséquent, il a 92 protons, 92 électrons et 238 – 92 = 146 neutrons. Son symbole est  U (ou 238U).
U (ou 238U).
La masse totale d’un atome s’appelle son poids atomique, et c’est presque mais pas exactement la somme des masses de ses protons, neutrons et électrons constituants. * Lorsque les protons, les neutrons et les électrons se combinent pour former un atome, une partie de leur masse est convertie en énergie et émise. (C’est la source d’énergie dans les réactions de fusion nucléaire.) Parce que l’atome ne peut pas être décomposé en ses particules fondamentales à moins que l’énergie de la masse manquante ne soit fournie de l’extérieur, cette énergie est appelée l’énergie de liaison du noyau.
Remarque: Poids atomique vs masse atomique
Les termes poids atomique et poids moléculaire sont universellement utilisés par les scientifiques en activité, et seront utilisés dans ce livre, même s’ils sont techniquement des masses plutôt que des poids.
| Electrons | Protons | Neutrons |
Atomique Nombre |
Poids atomique (amu) |
Charge totale (unités électroniques) |
|
|---|---|---|---|---|---|---|
| Atome d’hydrogène, 1H ou H | 1 | 1 | 0 | 1 | 1.008 | 0 |
| Atome de deutérium, 2H ou D | 1 | 1 | 1 | 1 | 2.014 | 0 |
| Atome de tritium, 3H ou T | 1 | 1 | 2 | 1 | 3.016 | 0 |
| Ion hydrogène, H + | 0 | 1 | 0 | 1 | 1.007 | +1 |
| Atome d’hélium, 4He | 2 | 2 | 2 | 2 | 4.003 | 0 |
| Noyau d’hélium ou particule alpha, He2 + ou α | 0 | 2 | 2 | 2 | 4,002 | +2 |
| Atome de lithium, 7Li | 3 | 3 | 4 | 3 | 7.016 | 0 |
| Atome de carbone, 12Ca | 6 | 6 | 6 | 6 | 12.000 | 0 |
| Atome d’oxygène, 16O | 8 | 8 | 8 | 8 | 15,995 | 0 |
| Atome de chlore, 35Cl | 17 | 17 | 18 | 17 | 34.969 | 0 |
| Atome de chlore, 37Cl | 17 | 17 | 20 | 17 | 36,966 | 0 |
| Mélange de chlore d’origine naturelle | 17 | 17 | 18 ou 20 | 17 | 35,453 | 0 |
| Atome d’uranium, 234U | 92 | 92 | 142 | 92 | 234.04 | 0 |
| Atome d’uranium, 235U | 92 | 92 | 143 | 92 | 235.04 | 0 |
| Atome d’uranium, 238U | 92 | 92 | 146 | 92 | 238,05 | 0 |
| Mélange d’uranium naturel | 92 | 92 | varié | 92 | 238.03 | 0 |
Exemple 1.2. 2
Calculez la masse perdue lorsqu’un atome de carbone-12 est formé à partir de protons, d’électrons et de neutrons.
Solution
Depuis le nu atomique mber de chaque atome de carbone est 6, le carbone-12 a 6 protons et donc 6 électrons. Pour trouver le nombre de neutrons, nous soustrayons le nombre de protons du nombre de masse: 12 – 6 = 6 neutrons. Nous pouvons utiliser les données du tableau 1-1 pour calculer la masse totale de ces particules:
| Protons: | 6 X 1,00728 amu = 6,04368 amu |
| Neutrons: | 6 X 1,00867 amu = 6,05202 amu |
| Electrons: | 6 X 0,00055 amu = 0,00330 amu |
| Masse totale des particules: 12,09900 amu |
Mais par la définition de l’échelle des unités de masse atomique, la masse d’un atome de carbone-12 est exactement 12 amu. Par conséquent, 0,0990 um de masse a disparu lors du processus de construction de l’atome à partir de ses particules.
Exemple 1.2.3
Calculez le poids atomique attendu de isotope du chlore qui a 20 neutrons. Comparez cela avec le poids atomique réel de cet isotope comme indiqué dans le tableau 1-2.
Solution
L’isotope du chlore a 17 protons et 20 neutrons:
| Protons: | 17 X 1,00728 amu = | 17,1238 amu |
| Neutrons: | 20 X 1,00867 amu = | 20,1734 amu |
| Électrons: | 17 X 0,00055 amu = | 0,0094 amu |
| Masse totale des particules: | 37,3066 amu | |
| Poids atomique réel observé: | 36,966 amu | |
| Perte de masse: | 0,341 amu |
Chaque isotope d’un élément est caractérisé par un numéro atomique (nombre total de protons), un nombre de masse (nombre total de protons s et neutrons) et un poids atomique (masse de l’atome en unités de masse atomique). Comme les pertes de masse lors de la formation d’un atome sont faibles, le nombre de masse est généralement le même que le poids atomique arrondi à l’entier le plus proche. (Par exemple, le poids atomique du chlore-37 est 36,966, qui est arrondi à 37.) S’il y a plusieurs isotopes d’un élément dans la nature, alors bien sûr le poids atomique observé expérimentalement (le poids atomique naturel) sera le poids moyenne des poids isotopiques. La moyenne est pondérée en fonction du pourcentage d’abondance des isotopes. Le chlore est présent dans la nature sous la forme de 75,53% de chlore-35 (34,97 amu) et de 24,47% de chlore-37 (36,97 amu), de sorte que la moyenne pondérée des poids des isotopes est
\
Le les poids atomiques donnés à l’intérieur de la quatrième de couverture de ce livre sont tous des moyennes pondérées des isotopes présents dans la nature, et ce sont les chiffres que nous utiliserons dorénavant, à moins que nous ne parlions spécifiquement d’un isotope. Tous les isotopes d’un élément se comportent de la même manière chimiquement pour la plupart. Leur comportement sera différent en ce qui concerne les propriétés sensibles à la masse telles que les taux de diffusion, que nous « verrons plus loin dans ce livre.
Exemple 1.2.4
Magnésium ( Mg) a trois isotopes naturels significatifs: 78,70% de tous les atomes de magnésium ont un poids atomique de 23,985 amu, 10,13% ont un poids atomique de 24,986 amu et 11,17% ont un poids atomique de 25,983 amu. Combien de protons et de neutrons sont présents dans chacun de ces trois isotopes? Comment écrire les symboles pour chaque isotope? Enfin, quelle est la moyenne pondérée des poids atomiques?
Solution
Il y a 12 protons en tout isotopes de magnésium. L’isotope dont le poids atomique est de 23,985 amu a un nombre de masse de 24 (protons et neutrons), donc 24 à 12 protons donnent 12 neutrons. Le symbole de cet isotope est 24Mg.986 amu a un nombre de masse de 25, 13 neutrons et 25Mg comme symbole. Le troisième isotope (25,983 amu) a un nombre de masse de 26, 14 neutrons et 26Mg comme symbole. Nous calculons le poids atomique moyen comme suit:
(0,7870 X 23,985) + (0,1013 X 24,986) + (0,1117 X 25,983) = 24,31 amu
Exemple 1.2.5
Le bore a deux isotopes naturels, lOB et 11B. On sait que 80,22% de ses atomes sont 11B, poids atomique 11,009 amu. À partir du poids atomique naturel indiqué sur la couverture arrière intérieure, calculez le poids atomique de l’isotope lOB.
Solution
Si 80,22% de tous les atomes de bore sont 11B, alors 100,00 – 80,22 , ou 19,78%, sont l’isotope inconnu. Nous pouvons utiliser W pour représenter le poids atomique inconnu dans notre calcul:
(0.8022 X 11.009) + (0.1978 XW) = 10.81 amu (poids atomique naturel) W =  = 10.01 amu
= 10.01 amu
Contributeurs et attributions
-
R. E. Dickerson, HB Gray et GP Haight, Jr. Le contenu a été utilisé à partir de « Chemical Principles », un texte d’introduction de niveau collégial pour la chimie générale avec la permission de la bibliothèque Caltech et Harry B. Gray, au nom des auteurs.
