Dette er mine notater fra forelæsning 15 i Harvard’s Chemistry 20: Organic Chemistry-kursus, leveret af Dr. Ryan Spoering den 6. marts 2015.
Optisk rotation
Det faktum, at enantiomerer roterer polariseret lys differentielt, er en nyttig egenskab til bestemmelse af sammensætningen af en blanding, som kan være et sted imellem racemisk (50/50) og ren (alle en enantiomer).
For chirale molekyler kan du slå en værdi kaldet 20D op. 20D betyder rotation ved 20 ° C med en kurvelængde på 1 dm under et natriumlys, hvor λ = 581 nm (natrium D-linjen, deraf D). Denne mængde sammen med parametrene c = koncentration i g / ml og l = kurlængde giver dig mulighed for at udlede den aktuelle rotation α i kraft af ligningen 20D = α / (cl).
| forhold | α | ee |
|---|---|---|
| 100: 0 | +12 | 100% |
| 90:10 | +9,6 | 80% |
| 50:50 | 0 | 0% |
Bemærk, at i en blanding af 90:10 annullerer de 10 ud af 90, så du ender med kun 80% af den rotation, du har i 100: 0-blandingen, for en 80 % ee.
Pasteur og vinsyre
I 1848 studerede Pasteur to tilsyneladende beslægtede stoffer, vinsyre og raceminsyre. Vinsyre er et naturligt stof, der nogle gange krystalliserer ud af vin, og det er dextrorotært. Raceminsyre var et industrielt biprodukt, der i alle henseender syntes at være identisk med vinsyre, bortset fra at det ikke havde nogen optisk rotation. Pasteur var en vitalist og var meget interesseret i at belyse det fysiske grundlag for, hvad der adskiller liv fra ikke-liv. Han formodede, at optisk rotation var specifik for vital kraft, fordi mange naturlige produkter var optisk aktive, mens syntetiske produkter næsten aldrig var.
Pasteur syntetiserede raceminsyre af natriumammonium og krystalliserede den derefter. Det dannede en bunke med to forskellige typer krystaller, som var makroskopisk adskilte. Med en pincet og et primitivt 1848-mikroskop kunne du faktisk plukke bunken fra hinanden i to separate bunker med krystaller, som var makroskopiske spejlbilleder af hinanden. Hvis du derefter genopløste de to bunker, ville hver være optisk aktiv, men i modsatte retninger.
Vi ved nu, at meget få racemiske blandinger opfører sig sådan. Langt størstedelen vil danne en racemisk krystal; kun en håndfuld danner separate krystaller. Desuden er det faktisk ganske vanskeligt at reproducere Pasteurs eksperiment, selv ved at vide dette.
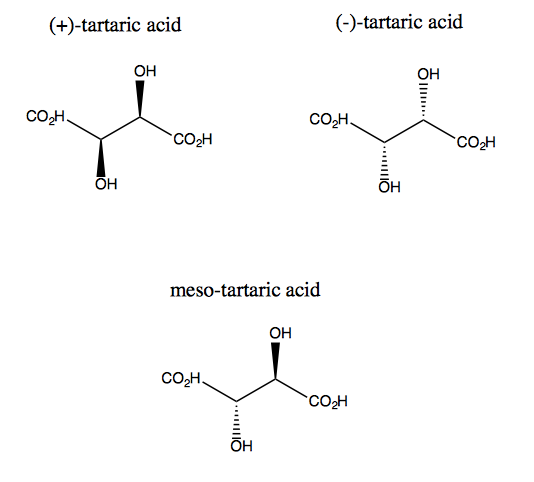
Vinsyre og dens enantiomer mangler plane symmetri, selvom de hver har to gange rotationssymmetri. Der findes intet plan, hvor du kan reflektere vinsyre og stadig overlejre det. Molekylet er således chiralt. Men hvis du forestiller dig, at z-aksen stikker ud af skærmen, kan du rotere molekylet 180 ° omkring denne akse og derefter overlejre det. Dette kaldes C2 symmetri. Vinsyre har også en diastereomer kaldet meso-vinsyre. Dette molekyle har et symmetriplan og er derfor achiralt. Generelt kaldes enhver forbindelse som denne, der har stereogene carbonatomer, men også et symmetriplan, en meso-forbindelse.
Stereospecificitet i syntese
Der er tre hovedstrategier til forberedelse af en enkelt enantiomer. I dag diskuterer vi et berømt eksempel, der berører to af disse tre metoder:
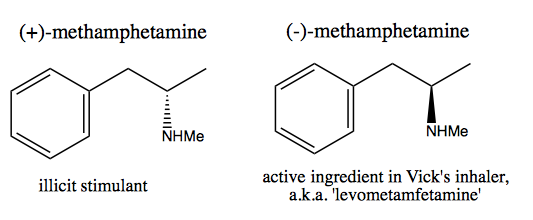
Folkene som Walter White , der ønsker at syntetisere ren dextromethamphetamin til kommercielt salg, har udviklet to metoder: chiral pool og opløsning.
Chiral pool
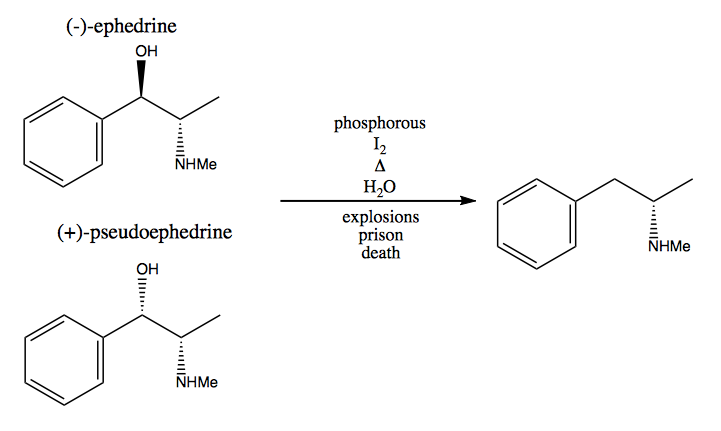
I metoden chiral pool stjæler du stereogene centre fra naturen. Naturen giver os en enorm pulje af chirale molekyler, som vi kan bruge som udgangsmaterialer. I tilfælde af dextromethamphetamin kan du starte fra (-) – efedrin eller (+) – pseudoephedrin og fjerne hydroxylgruppen via en meget farlig reaktion:
Opløsning
Da narkotikahåndhævelsesindsatsen har gjort det mere og mere vanskeligt at erhverve store mængder pseudoephedrin, har folk vendt sig mere mod afviklingsmetoden. I denne metode syntetiserer du først en racemisk blanding:
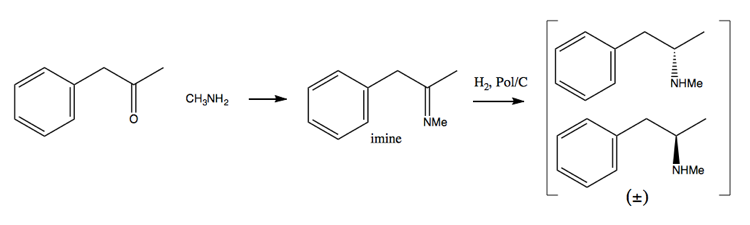
Derefter adskiller du den ved at tilføje et enantiopuremolekyle såsom (+ ) vinsyre. (+) – vinsyre danner salte med hver enantiomer, men de to salte har forskellige fysiske egenskaber, så under nøje forhold kan du kun få dextromethamphetamin til at krystallisere.
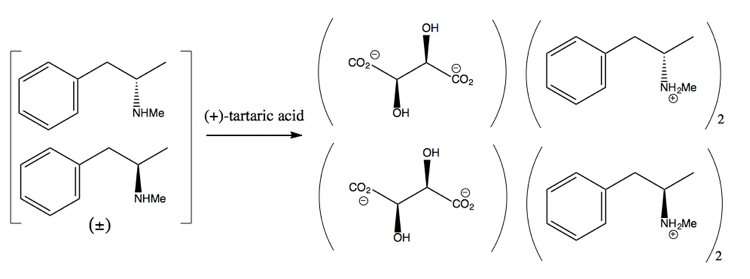
Dette er dog spild, da man i bedste fald får 50% udbytte, og i praksis er det svært at få lige så meget.
Chiralitet uden stereogent kulstof
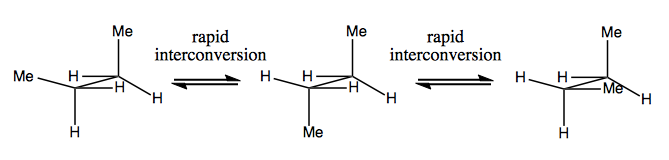
Næste gang vil vi diskutere molekyler, der har chiralitet uden stereogent kulstof. Disse er normalt ikke stabile og interkonverterer ret hurtigt. Her er et eksempel med et stereogent nitrogen:
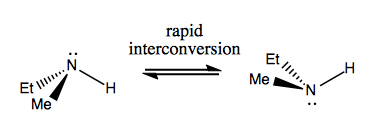
Der er også underlige eksempler, hvor et molekyle endnu ikke har et enkelt stereogent center formår at være chiral generelt. For eksempel har Gauche butan aksial chiralitet, selvom intet kulstof er stereogent. Det interkonverterer også hurtigt: