Úvod
Cukrová třtina (Saccharum spp., Poaceae) je roční nebo víceletá plodina pěstovaná v tropických a subtropických oblastech po celém světě. Cukrová třtina je důležitou plodinou pro produkci sacharózy a představuje 70% světové produkce cukru. Cukrová třtina navíc jako rostlina C4 může účinně přeměňovat sluneční energii na energii chemickou, a je proto ideální plodinou pro výrobu biopaliva pro výrobu ethanolu (Lam et al., 2009; Santchurn et al., 2014). Rod Saccharum má šest druhů: S. spontaneum, S. robustum, S. officinarum, S. barberi, S. sinense a S. edule, mezi nimiž je S. spontaneum považován za divoký druh se základní chromozomovou sadou x = 8. S. spontaneum je také jedním ze dvou hlavních druhů Saccharum, které přispívají k vývoji moderních kultivarů cukrové třtiny (Dhont et al., 1998; Ha et al., 1999). S. spontaneum má silnou adaptabilitu na životní prostředí a obsahuje důležité genetické vlastnosti pro odolnost vůči chorobám a suchu, což přispívá k toleranci stresu u moderních hybridních odrůd (Grivet et al., 2004). S. spontaneum má nejširší geografické rozšíření a jeho úrovně ploidie se pohybují od 2n = 5x = 40 do 2n = 16x = 128 (Panje a Babu, 1960).
Chromozomy cukrové třtiny mají podobné morfologie a mají malou velikost 1–6 μm ve fázi kondenzované metafáze (Ha et al., 1999; Dhont, 2005); proto je velmi náročné rozlišovat mezi různými chromozomy na základě tradičních cytogenetických metod. Navíc jako autopolyploid jsou velmi časté jeho chromozomální strukturní změny způsobené polyploidizací, duplikací, delecí a rekombinací (Piperidis et al., 2010). V S. spontaneum byly vyvinuty mapy genetických vazeb (Silva et al., 1995), ale vývoj cytologické genetické mapy zaostával za jinými druhy trav. Spolehlivé cytologické nástroje k identifikaci jednotlivých chromozomů lze použít k efektivnímu výzkumu genomu a využití zdrojů germplasmy, konkrétně s komplexním genomovým pozadím moderních kultivarů cukrové třtiny. Klony bakteriálních umělých chromozomů (BAC) specifických pro chromozomy jsou neocenitelným zdrojem pro výzkum genomu cukrové třtiny a budou mít mnoho aplikací ve fyzickém mapování, identifikaci chromozomů a šlechtění Saccharum spp. A v projektech sekvenování a montáže genomu cukrové třtiny. .
Fluorescenční in situ hybridizace (FISH) je mocný nástroj pro molekulární cytologii (Jiang a Gill, 2006). V Saccharum spp. Byly použity 45S rDNA a 5S rDNA jako sondy k detekci základních chromozomů S. spontaneum, S. robustum a S. officinarum, k identifikaci různých základních chromozomů, x = 8 v S. spontaneum a x = 10 u S. robustum a S. officinarum (Dhont et al., 1998; Ha et al., 1999). Na základě FISH bylo zjištěno, že moderní kultivary cukrové třtiny obsahují 70–80% chromozomů získaných z S. officinarum a 10–23% chromozomů ze S. spontaneum, zatímco 5–17% se jeví jako produkt rekombinace mezi S. spontaneum a S. officinarum (Dhont et al., 1996; Piperidis et al., 2001; Cuadrado et al., 2004). Kromě toho byly u některých progenitorů odvozených z hybridizace mezi Saccharum a Erianthus arundinaceus pomocí FISH detekovány události eliminace, rekombinace a translokace chromozomů (Dhont et al., 1995; Huang et al., 2015).
Sorghum má malý diploidní genom (730 Mbp) s nízkou frekvencí událostí rekombinace chromozomů. Čirok sdílí vysokou syntézu s genomem cukrové třtiny, což z něj činí ideální referenční rostlinu pro srovnávací analýzy s genomem cukrové třtiny (Ming et al., 1998; Nazeema et al., 2007; Wang et al., 2010; Aitken et al., 2014 ). V této studii byly na základě dostupných sekvencí pro zdroje BAC s vysokým pokrytím vyvinuty spolehlivé sondy BAC pro identifikaci FISH chromozomů a konstrukci cytogenetické mapy. Cíle této studie byly: (1) vyvinout sadu chromosomově specifických sond BAC-FISH na chromozomu S. spontaneum a (2) prozkoumat přeskupení chromozomů mezi S. spontaneum a čirokem.
Materiály a metody
Materiály
V této studii bylo pro cytologické analýzy použito Saccharum spontaneum SES208 (2n = 8x = 64). Rostliny SES208 byly pěstovány na poli v areálu Fujianské zemědělské a lesnické univerzity (Fuzhou, Čína) v únoru 2015 a udržovány za podmínek pravidelného růstu cukrové třtiny.
Z haploidního genomu byla vytvořena knihovna BAC. S. spontaneum AP85-441 (4x = 32), který byl odvozen od S. spontaneum SES208 (2n = 8x = 64) prašníkem in vitro. Velikost genomu AP85-441 je přibližně 3,2 Gbp. Knihovna se skládala z 38 400 klonů, s průměrnou velikostí inzertu 100 kb, pokrývající 6 × celého genomu.Tato knihovna BAC byla použita k identifikaci transportérů sacharózy a genových rodin fruktokinázy v S. spontaneum (Zhang et al., 2016; Chen et al., 2017).
Screening the BAC Library
35 156 klonů BAC z knihoven AP85-441 bylo sloučeno do 701 knihoven. Každá knihovna obsahuje průměrně 50 BAC klonů. Knihovny DNA byly připraveny pomocí PhasePrepTM BAC DNA Kit (Sigma, USA) podle protokolů výrobce. Knihovny BAC DNA byly sekvenovány pomocí platformy Illumina HiSeq 2500 s modelem PE250. Celkem bylo sekvenováno 686 knihoven (18 knihoven selhalo při sekvenování) a po ořezání pomocí Trimmomatic verze 0.36 bylo vygenerováno 267,5 Gb vyčištěných dat (Bankevich et al., 2012). Data z každého fondu BAC byla shromážděna pomocí SPAdes verze 3.09 s výchozím parametrem. Bylo shromážděno celkem 2 611 145 kontig s kontig N50 7,38 kbp (Zhang a Ming, nepublikovaná data).
Sekvence knihovny BAC AP85-441 byly BLAST prohledávány proti genomu čiroku s E-hodnotou 1e -4. Sekvence, které měly v genomu čiroku jediný zásah BLAST, byly vybrány jako kandidátské sondy FISH. K identifikaci BAC klonů s nízkým počtem kopií z BAC knihovny byly navrženy sekvenčně specifické primery pomocí softwaru Primer 5.0, aby bylo možné specificky skrínovat BAC pooly pomocí PCR. Byly vybrány délky primerů 18–25 bp, hodnoty Tm 55–65 ° C a nukleotidové složení 40–60% cytosinu a guaninu. K screeningu fondů 3D dimenzí BAC knihovny byla použita dvoustupňová metoda PCR (Asakawa et al., 1997; Crooijmans et al., 2000) s některými modifikacemi. Každý klon z 384-jamkové destičky byl kultivován v 80 ul Lysogenyho bujónu + 34 mg / ml chloramfenikol přes noc při 37 ° C na 384-jamkové kultivační destičce. Celkem bylo kultivováno osm 384jamkových destiček s celkem 3072 BAC klony. Pro každou 384jamkovou destičku jsme nejprve zkonstruovali 16 řadových skupin (řada A až P) a 24 skupin sloupců (sloupec 1–24) pro každou 384jamkovou destičku smícháním stejných objemů kultury každého jednotlivého klonu a poté smíchali 16 řadových fondů a 24 sloupcových fondů společně se stejnými objemy z každého fondu řádků a sloupců jako jeden deskový fond nebo superpoolovaný fond. V této studii jsme se zaměřili na screening osmi 384jamkových destiček. Pro osm desek bylo tedy samostatně připraveno osm superpooly. Pozitivní 384jamková destička z osmi destiček byla identifikována a následně byl testován pozitivní řádek mezi 16 směsmi. Nakonec byly PCR pozitivní kolony vybrány ze 24 směsí kolon. Bylo provedeno dvacet čtyři PCR reakcí k identifikaci pozitivních klonů z osmi 384-jamkových destiček.
PCR amplifikace byly provedeny tak, jak bylo popsáno výše (Bouzidi et al., 2006). Každá reakce zahrnovala premix rTaq 7,5 μl, 0,6 μl každého primeru (10 μM), 1,0 μl bakteriálního kapalného templátu, na konečný objem 20 μl. Po počáteční denaturaci při 95 ° C po dobu 5 minut bylo provedeno 35 cyklů 95 ° C po dobu 30 s, 55 ° C po dobu 30 s a 72 ° C po dobu 1 minuty. Produkty PCR byly analyzovány na 1,5% agarózovém gelu.
Příprava chromosomů metafáze
Příprava chromozomu byla prováděna tak, jak bylo popsáno výše (Lou et al., 2010) s malými modifikacemi. Stručně řečeno, rostliny S. spontaneum byly pěstovány ve skleníkových podmínkách pro sběr špiček kořenů. Vyříznuté kořenové špičky asi 1–2 cm byly ošetřeny 0,002 mol / l 8-hydroxychinolinu při pokojové teplotě po dobu 2–4 hodin, opláchnuty ve vodě po dobu 15 minut a fixovány v ethanolu: kyselině octové (3: 1) po dobu nejméně 24 h při pokojové teplotě. Špičky kořenů byly poté natráveny v roztoku enzymu (4% celulóza R-10 a 2% pektolyáza v 0,1 M citrátovém pufru) při 37 ° C po dobu 1 hodiny, promyty ledovou deionizovanou vodou po dobu 30 minut a nakonec inkubovány v ethanolu: kyselina octová (3: 1) po dobu asi 30 minut. Sklíčka byla připravena pomocí metody „vysušené plamenem“ (Iovene et al., 2008).
Purifikace BAC DNA a značení sond
BAC DNA byla extrahována pomocí PhasePrepTM BAC DNA Kit podle příručky výrobce. Vyčištěná BAC DNA byla označena standardní reakcí translace nicků, včetně zředěné DNázy I, 10 × pufru translace nicku, DNA Polymerasy I, dNTP, biotinem / digoxigeninem označených dUTP a BAC DNA. byla inkubována při 15 ° C po dobu 1,5 h. Nařezané produkty byly poté zkoumány na 1,5% agarózovém gelu na přítomnost nátěru mezi 300 a 500 bp. Získané sondy byly až do použití skladovány při -20 ° C.
Hybridizace a detekce in situ
Směs sond a hybridizace: Nejprve směs sondy (50% deionizovaný formamid, 2 × SSC, 80 ng DNA značená digoxygeninem / biotinem, 10% dextran sulfát , > 1 μg C ° t-100) byl umístěn na 5 minut do horkého bloku o teplotě 90 ° C, poté byl okamžitě přenesen na led, dokud nebyl připraven k hybridizaci na. Na dříve připravená plamenem sušená sklíčka se působilo 70% deionizovaným formamidem, denaturovaným na tepelném bloku při 80 ° C po dobu 1.5 minut, bezprostředně postupně ponořeno do ledově chladného 70% ethanolu, 90% ethanolu a poté 100% ethanolu po dobu 5 minut a poté sušeno na vzduchu na stolici. Nakonec byly ke každému sklíčku přidány denaturované sondy a překryty krycími sklíčky 24 × 32 mm. Sklíčka byla umístěna do vlhké komory při 37 ° C přes noc.
Detekce sondy: krycí sklíčka byla odstraněna a sklíčka byla promývána při teplotě místnosti ve 2 × SSC po dobu 5 minut, při 42 ° C ve 2 × SSC po dobu 10 minut a při teplotě místnosti v 1 × PBS po dobu 5 minut v tomto pořadí. Signály sondy značené biotinem byly detekovány 2 mg / ml streptavidinu Alexa Fluor 488 a signály sondy značené digoxygeninem byly detekovány 2% anti-digoxigenin-rhodaminu z ovcí. Protilátkový koktejl (100 μl pufru TNB, 1 μl streptavidinu Alexa Fluor 488, 1 μl rhodaminového anti-dig-ovce) byl přidán ke sklíčkům, která byla pokryta krycími sklíčky 24 × 32 mm, inkubována po dobu 1 hodiny při 37 ° C v vlhká komora a promyta při teplotě místnosti v 1 x PBS třikrát po dobu 5 minut. Přebytečná kapalina byla odstraněna a byl přidán 4 ‚, 6-diamidino-2-fenylindol (DAPI) (Sigma, St. Louis, MO, USA) v roztoku proti vyblednutí Vectashield (Vector, Burlingame, CA, USA), aby došlo k vybarvení chromozomy. Snímky byly pořízeny epifluorescenčním mikroskopem Olympus BX63. Signální obrazy FISH byly analyzovány pomocí softwaru CellSens Dimension.
Výsledky
Screening BAC klonů s nízkou kopií
K screeningu BAC klonů, které mají potenciálně nízký počet kopií sekvence v genomu S. spontaneum, jsme BLAST prohledali sekvenované BAC knihovny AP85-441 proti genomu čiroku. Bylo testováno celkem 2 000 BAC sekvencí odpovídajících 10 chromozomům čiroku s dobrou kolinearitou a vykazující sekvenční specificitu. Sekvence BAC 2000 AP85-441 byly maskovány programem REPEATMASKER proti databázi DNA s vysokým opakováním čiroku a databázi TIGR gramineae za účelem filtrování opakovaných sekvencí. Nakonec bylo pro analýzu FISH vybráno 114 BAC distribuovaných na 10 chromozomech čiroku (doplňková tabulka 1) se 7–16 BAC na každém z 10 chromozomů čiroku (obrázek 1). Pro screening pozitivních klonů BAC bylo navrženo 114 specifických primerů na základě sekvencí klonů BAC (doplňková tabulka 2) a 49 pozitivních klonů BAC bylo testováno z knihoven BAC (doplňková tabulka 3).
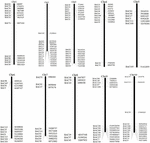
OBRÁZEK 1. Distribuce 114 BAC klonů z AP85-441 v chromozomech čiroku. BAC1-114 představuje číslo BAC, údaje vpravo jsou fyzické umístění BAC v odpovídající oblasti chromozomů čiroku. Unit = bp.
Síla a distribuce signálu BAC-FISH
Vzorky DNA izolované ze 49 pozitivních Klony BAC byly značeny biotinem nebo digoxigeninem. Jako kontrola byly použity sondy 5S rDNA a 45S rDNA, které byly hybridizovány na somatické metafázové chromozomy S. spontaneum podle postupu FISH. Kvůli korelaci mezi silou signálu a variací opakovaného obsahu sekvencí sekvencí BAC jsme jako konkurenta použili C ° t-100 (tabulka 1). Klony BAC zobrazující silné a stabilní hybridizační signály byly vybrány pro další analýzu FISH.

TABULKA 1. Klasifikace 27 pozitivních klonů s blokující DNA.
Lze pozorovat celkem 64 odlišných chromozomů v metafázi S. spontaneum. Každá BAC-FISH byla provedena ve čtyřech nezávislých experimentech (nebo diapozitivech). Na každém sklíčku bylo analyzováno alespoň 10 pomazání somatických metafázových chromozomů. Výsledky ukázaly, že 27 specifických sond (doplňková tabulka 4) lze rozdělit do pěti skupin na základě signálu hybridizace (tabulka 1). Ve skupině I (včetně BAC-18, BAC-20, BAC-29 a BAC-84) zobrazovaly sondy osm charakteristických míst bez kompetitivní suprese in situ (CISS) pomocí C ° t-100 (obrázek 2A), což naznačuje několik opakovaných sekvence existovaly v těchto BAC sekvencích. Ve skupině II (včetně BAC-2, BAC-11, BAC-14, BAC-19, BAC-31, BAC-33, BAC-43, BAC-71, BAC-73 a BAC-74), ° C -100 byl použit jako kompetitor pro hybridizaci sondy BAC a v karyotypech této skupiny bylo zobrazeno šest až sedm zcela odlišných míst (obrázek 2B). Výsledek hybridizace byl podobný 45S rDNA se sedmi signálními místy, což může být způsobeno variací struktury chromozomu v homologním chromozomu. Ve skupině III (včetně BAC-26, BAC-66, BAC-76 a BAC-78) byla jako konkurence použita DNA C ° t-100 a v karyotypu bylo možné pozorovat osm odlišných míst, což naznačuje tuto skupinu BAC klony mají opakující se sekvence DNA (obrázek 2C). Ve skupině IV (včetně BAC-24) bylo v karyotypu pozorováno více než osm signálních míst a objevilo se v pericentromerických a telomerních oblastech (obrázek 2D), což naznačuje, že tyto BAC sondy měly opakující se sekvence v S. spontaneum.Ve skupině V (včetně BAC-4, BAC-5, BAC-32, BAC-34, BAC-35, BAC-69, BAC-77 a BAC-81) vykazovaly sondy rozptýlené signály ve všech chromozomech s omezenými oblastmi jednotlivých chromozomů zobrazujících specifické signály (obrázek 2E). Výsledek hybridizace naznačil, že tato skupina klonů BAC obsahovala velké množství repetitivní DNA v S. spontaneum, což může být způsobeno rychlou evoluční divergencí pro repetitivní oblasti po rozdělení čiroku a S. spontaneum. Proto ze 49 sond BAC vykazovala sada 19 sond BAC (doplňková tabulka 3) ze skupin I, II a III specifické signály na chromozomech S. spontaneum odpovídajících devíti chromozomům čiroku vedle Sb05. Signály dalších 22 sond byly rozptýleny ve všech chromozomech. Jako signály specifické pro chromozom S. spontaneum jsme vybrali sadu 19 sond BAC (obrázek 3). Z 19 BAC sond byla jedna sonda umístěna na Sb02, Sb04 a Sb09; dvě sondy na Sb07, Sb08 a Sb10; tři sondy na Sb01 a Sb06; a čtyři sondy na Sb03. Tato sada sond poskytla užitečný nástroj pro srovnávací analýzu S. spontaneum a čiroku (tabulka 2).
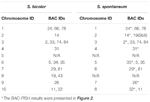
TABULKA 2. Distribuce sond BAC-FISH v chromozomech S. bicolor a S. spontaneum.
Výstavba knihovny BAC specifické pro chromozomy S. spontaneum
Sb01 a Sb02 jsou dva největší chromozomy čiroku. K detekci syntézy genomu mezi čirokem a S. spontaneum bylo vybráno 10 chromozomově specifických BAC klonů ze skupin I, II a III. Z těchto 10 BAC sond byly tři sondy (BAC klon ID: 24, 66, 78) homologní k Sb01 a sedm sond (BAC klon ID: 14, 18, 20, 69, 71, 73, 77) odpovídalo Sb02. Využili jsme dvoubarevnou detekci FISH pro doplňkově značené páry BAC a sondy pro mapování řetězového cytogenetického vztahu pro BAC klony. Tímto způsobem jsme zkonstruovali cytogenetickou mapu S. spontaneum na základě 10 BAC sond.
U tří sond odpovídajících Sb01 ukázala FISH analýza S. spontaneum (SES208), že BAC-24 a BAC -78 sond bylo umístěno hlavně v distální oblasti S. spontaneum chromozomu 1 a BAC-66 byl mapován v těsné blízkosti centromerické oblasti (obrázek 4). BAC-24 a BAC-66 lokalizované do stejného chromozomu (S. spontaneum chromozom 1); současně sonda 66 a sonda 78 také umístěné na stejném chromozomu, což ukazuje, že tři BAC sondy se distribuovaly do stejných chromozomů v S. spontaneum, což naznačuje syntézu mezi S. spontaneum a čirokem pro chromozom 1. Výsledky FISH odhalily, že sedm BAC sond zarovnáno na Sb02; pouze sondy 69, 71, 73 a 77 ze sedmi BAC generovaly intenzivní signály na jednom chromozomu S. spontaneum (SsChr2) (obrázek 5); zatímco sondy 14, 18 a 20 nebyly detekovatelné na chromozomu 2 S. spontaneum, ale byly pozorovány na jiných chromozomech S. spontaneum. Tyto výsledky ukázaly, že došlo k přeskupení chromozomů v odpovídajícím Sb02 mezi S. spontaneum a čirokem.
Sekvence BAC-2 měla navíc vysokou podobnost (97%) s fragmentem na chromozomu 3 čirok. Dvoubarevná analýza FISH ukázala, že rDNA BAC-2 i 45s byly mapovány na stejné místo chromozomu S. spontaneum (obrázek 6).
Přesmyk chromozomů na Sb02 mezi čirokem a S. spontaneum
Chcete-li dále zkoumat přeskupení chromozomů na Sb02 mezi čirokem a S. spontaneum, chromozom pro FISH analýzu byly použity specifické sondy odpovídající Sb02 (BAC-14, BAC-18 a BAC-20) a odpovídající Sb08 (BAC-19 a BAC-43). Výsledky ukázaly, že BAC-14 a BAC-19 byly mapovány do různých ramen stejných chromozomů S. spontaneum, což naznačuje, že k přeuspořádání chromozomů došlo mezi chromozomy 2 a 8 v S. spontaneum a čiroku (obrázek 7).
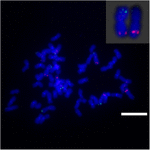
OBRÁZEK 7. Přesmyk chromozomu v cukrové třtině a čiroku, jak odhalila FISH. Sondy BAC-14 a BAC-19 značené biotinem (zelená) a digoxigeninem (červená). Stupnice = 10 μm.
Diskuse
Sacharum je komplexní rod charakterizovaný vysokou úrovní polyploidie, s malými chromozomy (Ha et al., 1999; Dhont, 2005). Rozlišovat jednotlivé chromozomy Saccharum na základě jejich morfologie je velmi náročné. S využitím výhod sekvencí, které jsou vysoce pokryty BAC knihovnou S. spontaneum, jsme byli schopni skrínovat potenciálně nízký počet kopií BAC klonů v S. spontaneum pomocí genomu čiroku jako reference. Jako vysoce polyploidní druh může S. spontaneum obsahovat více přesmyků genomu než diploidy.Rozdíly genomů mezi S. spontaneum a čirokem mohou být příčinou nepřesnosti v předpovědích BAC sekvencí s nízkým počtem kopií v genomu S. spontaneum. V této studii jsme původně získali 114 potenciálních BAC sekvencí s jednou kopií založenou na genomu čiroku. V parciálních knihovnách BAC však bylo možné identifikovat pouze 49 a bylo zjištěno, že 27 jsou sondy BAC-FISH specifické pro chromozomy. Existují nejméně dva důvody pro vysvětlení těchto výsledků. Za prvé, 114 sekvencí BAC byly částečné fragmenty inzerce BAC kvůli omezením sestavy sekvence NGS a mohou obsahovat opakované sekvence v jiných oblastech, které nemají žádné informace o sekvenci. Tyto potenciálně odkryté opakované sekvence by mohly zmást detekci sekvence s nízkým počtem kopií porovnáním sekvencí. Zadruhé, nedávná polyploidizace v S. spontaneum může způsobit variace opakovaných sekvencí mezi S. spontaneum a čirokem, a tak vést k nespecifickému signálu FISH v S. spontaneum. V předchozí studii generovalo sekvenování 20 BAC v hybridech cukrové třtiny 1,45 Mb kontrolní sekvence, sekvence srovnávající s genomem čiroku trvaly 0,99 Mb, což představovalo asi polovinu BAC sekvencí cukrové třtiny (Wang et al., 2010). Je zřejmé, že delece / inzerce existovaly mezi čirokem a Saccharum a využití genomu čiroku jako reference nemůže nahradit jedinečné vlastnosti genomu Saccharum, a tak může způsobit nepředvídané výsledky FISH.
Některé snímky FISH měly silné šum pozadí, který může být způsoben malými oblastmi opakujících se sekvencí (jako jsou sekvence SSR) v BAC klonu, které následně způsobují interferenci během hybridizace. Genom čiroku má obsah opakování přibližně 61% (Paterson et al., 2009), zatímco přibližně polovina genomu je složena z repetitivních sekvencí u hybridů Saccarrum (De et al., 2014). V těchto genomech bohatých na opakování je obtížné vyvinout signální specifické sondy FISH, které cytogeneticky odlišují chromozomy od podobných morfologií. CISS s blokující DNA C ° t-100 může účinně vyloučit opakované sekvence. V této studii byla blokující DNA C ° t-100 použita pro FISH analýzu sond BAC ve skupinách II a III (obrázky 2D – F), u nichž bylo ověřeno, že jsou chromosomově specifické BAC sondy, zatímco FISH sond BAC ve skupinách IV a V způsobovalo silné rušení pozadí (obrázky 2D – F). Je zřejmé, že mezi zkoumanými BAC sondami existují variace opakovaných sekvencí. Pro analýzu BAC-FISH v Saccharum by proto byla nutná optimalizace experimentů. Ve skupině II bylo zobrazeno šest až sedm míst, což mohlo být způsobeno variacemi homologní chromozomové struktury, jako je delece fragmentu v jednom nebo dvou homologních chromozomech. V hexaploidní pšenici BAC 676D4 hybridizoval silněji s chromozomy A-genomu než s chromozomy B- a D-genomu (Zhang et al., 2004). Tyto nezjistitelné signály jednoho až dvou v homologních chromozomech mohou být způsobeny také technickými problémy BAC-FISH pro tolik chromozomů s malou velikostí.
V této studii jsme identifikovali 27 chromozomově specifických BAC- Sondy FISH, které odpovídají 9 z 10 chromozomů čiroku (všechny kromě Sb05). Ve studii genetické mapy odvozené z křížení mezi S. officinarum a kultivarem cukrové třtiny byl Sb05 sloučen se Sb06 v cukrové třtině (Aitken et al., 2014). V naší studii genetická mapa založená na F1 populaci S. spontaneum odhalila, že Sb05 byl rozdělen do dvou segmentů a tyto dva segmenty byly sloučeny s Sb06 a Sb07 (Zhang a Ming, nepublikovaná data). Nedávno genetická mapa člena Andropogoneae, Miscanthus sinensis, prokázala, že Sb05 má špatnou kolineárnost s odpovídající vazebnou skupinou v M. sinensis (Ma et al., 2012). Podobně si dva chromozomy kukuřice předků kolmé k Sb05 zachovávají nejmenší počet syntenických ortologů vůči genům čiroku (Schubert a Lysak, 2011). Nepřítomnost BAC-FISH odpovídající Sb05 může tedy indikovat fúzi chromozomů v S. spontaneum.
Čirok a S. spontaneum se rozcházely před 12 miliony let (MYA), počet základních chromozomů byl snížen z x = 10 až x = 8. V Aitken a kol. (2014), HG2 (homologní skupina 2) cukrové třtiny zarovnaná k Sb05 a Sb06 a HG8 (homologní skupina 8) k Sb02 a Sb08, což poskytuje důkazy o základní události redukce chromozomů (Aitken et al., 2014). V této studii jsme pozorovali, že čirokové chromozomy Sb02 a Sb08 měly interchromozomální přesmyk v S. spontaneum, jak dokazují důkazy, že BAC-14 se srovnával s Sb02 a BAC-19 se srovnával s Sb08 (obrázek 7). Naše studie poskytla první fyzický a cytogenetický důkaz mezichromozomového přesmyku čiroku v S. spontaneum. Nepublikovaná data z naší skupiny také odhalila, že Sb08 je rozdělen do dvou segmentů a byly sloučeny s Sb02 a Sb09 v S. spontaneum (Zhang a Ming, nepublikovaná data).Sondy odpovídající Sb09, Sb08, Sb05 a Sb06 by mohly být dále použity pro vyšetřování mezichromozomálních událostí mezi čirokem a S. spontaneum. S. spontaneum má širokou škálu úrovní ploidie (2n = 40–128) (Irvine, 1999). Tyto sondy BAC by mohly být použity k potvrzení mezichromozomálního přeskupení S. spontaneum s různými hladinami polyploidií.
Kvůli odlišnému základnímu počtu chromozomů mezi čirokem (x = 10) a S. spontaneum (x = 8), chromozomy čiroku nebyly korespondencí jedna k jedné se S. spontaneum. Jak zde byla zmíněna naše studie genetického mapování dříve, Sb08 byl rozdělen na dva segmenty, které se spojily se segmenty Sb02 a segmenty Sb09 v S. spontaneum; Sb05 byl rozdělen na dva segmenty, které se spojily se segmenty Sb06 a segmenty Sb07 S. spontaneum. Sondy odpovídající Sb08 a Sb05 proto nebyly specifické pro jednotlivé chromozomy S. spontaneum, zatímco ostatní sondy odpovídající dalším osmi chromozomům čiroku lze použít jako cytogenetické sondy BAC-FISH specifické pro chromozomy pro S. spontaneum. Testované sondy BAC tedy byly založeny na osmi chromozomech čiroku (tabulka 2) dostatečných pro identifikaci chromozomů pomocí BAC-FISH. Satelitní chromozom byl nalezen v jednom chromozomu S. spontaneum (chromozom 3) (Ha et al., 1999). Dříve simultánní FISH odhalila, že signály 45S rDNA byly lokalizovány na sekundárních konstrikcích satelitních chromozomů v chromozomu 3 z klonu S. spontaneum odvozeného od prašníkové kultury (AP85-361) (Ha et al., 1999). V této studii byl BAC-2, který odpovídá Sb03 a 45s rDNA, mapován na stejné místo chromozomu S. spontaneum, což dále podporuje předchozí nálezy (Ha et al., 1999). Naše výsledky také poskytly přímý důkaz, že chromozom 3 S. spontaneum pojmenovaný v předchozí studii je homologní se Sb03.
Závěr
V této studii jsme vyvinuli BAC specifické pro chromozom S Spontaneum jako krok k vývoji jednoduché a reprodukovatelné metody identifikace chromozomů pomocí cytogenetických markerů BAC-FISH, což potvrzuje proveditelnost izolace chromozomově specifických BAC na základě genomu čiroku za účelem vytvoření fyzické mapy cukrové třtiny. Poskytujeme také první cytogenetický důkaz mezichromozomálního přeskupení mezi čirokem a S. spontaneum. Zřízení technologického systému BAC-FISH z cukrové třtiny nabízí nové příležitosti a prostředky pro výzkum molekulární cytogenetiky cukrové třtiny, včetně analýzy karyotypů, lokalizace genů a konstrukce fyzické mapy. Tyto výsledky jsou nezbytné pro shromáždění genomu S. spontaneum požadovaného pro sekvenování celého genomu.
Autorské příspěvky
GD, JS a JZ studii pojaly a navrhly experimenty. GD, JS, QZ, JW, QY, RM, KW a JZ provedly experimenty a analyzovaly data. GD a JZ napsali rukopis. Všichni autoři přečetli a schválili závěrečnou práci.
Financování
Tento projekt byl podpořen granty z programu 863 (2013AA102604), NSFC (31201260), Programu pro vynikající talenty nového století v Univerzita provincie Fujian a financování z univerzity zemědělství a lesnictví Fujian.
Prohlášení o střetu zájmů
Autoři prohlašují, že výzkum byl proveden bez jakýchkoli obchodních nebo finančních vztahů to by mohlo být vykládáno jako potenciální střet zájmů.
Poděkování
Děkujeme Dr. Xintan Zhangovi za sestavení sekvencí BAC a Dr. Irene Lavagi za editaci angličtiny.
Doplňkový materiál
Dhont, A. (2005). Rozluštění struktury genomu polyploidů pomocí FISH a GISH; příklady cukrové třtiny a banánů. Cytogenet. Genome Res. 109, 27–33. doi: 10.1159 / 000082378
PubMed Abstract | CrossRef Full Text | Google Scholar
Piperidis, G., D’Hont, A. a Hogarth, D. M. (2001). „Analýza složení chromozomů různých mezidruhových hybridů Saccharum pomocí genomových in situ (hybridizace) (GISH),“ ve sborníku Mezinárodní společnosti technologů cukrové třtiny, XXIV. Kongres (Brisbane, QLD: ASSCT), 565–566.
Google Scholar
