Inledning
Sockerrör (Saccharum spp., Poaceae) är en årlig eller flerårig gröda som odlas i tropiska och subtropiska regioner världen över. Sockerrör är en viktig gröda för sackarosproduktion och står för 70% av världens sockerproduktion. Dessutom kan sockerrör som en C4-anläggning effektivt omvandla solenergi till kemisk energi och är därför en idealisk biobränslegrödor för etanolproduktion (Lam et al., 2009; Santchurn et al., 2014). Släktet Saccharum har sex arter: S. spontaneum, S. robustum, S. officinarum, S. barberi, S. sinense och S. edule, bland vilka S. spontaneum anses vara den vilda arten med en grundläggande kromosomuppsättning av x = 8. S. spontaneum är också en av de två huvudsakliga Saccharum-arterna som bidrar till den moderna utvecklingen av sockerrörsorter (Dhont et al., 1998; Ha et al., 1999). S. spontaneum har en stark miljöanpassningsförmåga och innehåller viktiga genetiska egenskaper för resistens mot sjukdomar och torka, vilket bidrar till stresstoleransen hos moderna sorthybrider (Grivet et al., 2004). S. spontaneum har den största geografiska fördelningen och dess ploidnivåer sträcker sig från 2n = 5x = 40 till 2n = 16x = 128 (Panje och Babu, 1960).
Kromosomer av sockerrör har liknande morfologier och har en liten storlek på 1–6 μm vid det kondenserade metafasstadiet (Ha et al., 1999; Dhont, 2005); därför är det mycket utmanande att urskilja mellan de olika kromosomerna baserat på traditionella cytogenetiska metoder. Dessutom, som en autopolyploid, är dess kromosomala strukturella förändringar orsakade av polyploidisering, duplicering, radering och rekombination mycket vanliga (Piperidis et al., 2010). I S. spontaneum har genetiska länkkartor utvecklats (Silva et al., 1995), men utvecklingen av en cytologisk genetisk karta släpar efter andra gräsarter. Pålitliga cytologiska verktyg för att identifiera enskilda kromosomer kan användas för effektiv genomforskning och utnyttjande av bakterieplasmresurser, särskilt med den komplexa genombakgrunden hos moderna sockerrörsorter. Kromosomspecifika bakteriella artificiella kromosomkloner (BAC) är ovärderliga resurser för sockerrörsgenomforskning och kommer att ha många tillämpningar inom fysisk kartläggning, kromosomidentifiering och markörassisterad avel av Saccharum spp. .
Fluorescens in situ hybridisering (FISH) är ett kraftfullt verktyg för molekylär cytologi (Jiang och Gill, 2006). I Saccharum spp. Användes 45S rDNA och 5S rDNA som prober för att detektera baskromosomerna i S. spontaneum, S. robustum och S. officinarum, för att identifiera de olika baskromosomerna, x = 8 i S. spontaneum och x = 10 i S. robustum och S. officinarum (Dhont et al., 1998; Ha et al., 1999). Baserat på FISH befanns moderna sockerrörsorter innehålla 70-80% av kromosomerna härledda från S. officinarum och 10-23% av kromosomerna från S. spontaneum, medan 5-17% verkar vara produkten av rekombinationen mellan S. spontaneum och S. officinarum (Dhont et al., 1996; Piperidis et al., 2001; Cuadrado et al., 2004). Dessutom upptäcktes kromosomeliminering, rekombination och translokationshändelser i vissa stamfäder härledda från hybridiseringen mellan Saccharum och Erianthus arundinaceus med användning av FISH (Dhont et al., 1995; Huang et al., 2015).
Sorghum har ett litet diploid genom (730 Mbp) med låg frekvens av kromosomrekombinationshändelser. Sorghum delar hög synten med sockerrörsgenomet, vilket gör den till en idealisk referensväxt för jämförande analyser med sockerrörsgenomet (Ming et al., 1998; Nazeema et al., 2007; Wang et al., 2010; Aitken et al., 2014 ). I denna studie, baserat på tillgängliga sekvenser för BAC-resurser med hög täckning, utvecklades tillförlitliga BAC-prober för FISH-kromosomidentifiering och cytogenetisk kartkonstruktion. Syftet med denna studie var att: (1) utveckla en uppsättning kromosomspecifika BAC-FISH-sonder på S. spontaneum-kromosom och (2) utforska kromosomomläggningen mellan S. spontaneum och sorghum.
Material och metoder
Material
Saccharum spontaneum SES208 (2n = 8x = 64) användes för cytologiska analyser i denna studie. SES208-växterna odlades på fältet på campus vid Fujian Agricultural and Forestry University (Fuzhou, Kina) i februari 2015 och underhölls under regelbundna sockerrörstillväxtförhållanden.
Ett BAC-bibliotek konstruerades från det haploida genomet av S. spontaneum AP85-441 (4x = 32), som härstammar från S. spontaneum SES208 (2n = 8x = 64) via anther in vitro-kultur. Genomstorleken på AP85-441 är cirka 3,2 Gbp. Biblioteket bestod av 38 400 kloner, med en genomsnittlig skärstorlek på 100 kb, som täckte 6 × av hela genomet.Detta BAC-bibliotek har använts för att identifiera sackarostransportörer och fruktokinasgenfamiljer i S. spontaneum (Zhang et al., 2016; Chen et al., 2017).
Screening av BAC-biblioteket
35 156 BAC-kloner från AP85-441-biblioteken slogs samman i 701 bibliotek. Varje bibliotek innehåller i genomsnitt 50 BAC-kloner. DNA-biblioteken bereddes med PhasePrepTM BAC DNA Kit (Sigma, USA) enligt tillverkarens protokoll. BAC-DNA-bibliotek sekvenserades med Illumina HiSeq 2500-plattform med PE250-modell. Totalt 686 bibliotek (18 bibliotek misslyckades för sekvensering) sekvenserades, och 267,5 Gb av rengjorda data genererades efter trimning med hjälp av Trimmomatic version 0.36 (Bankevich et al., 2012). Data från varje BAC-pool samlades med SPAdes version 3.09 med standardparameter. Totalt 2,611,145 contigs samlades med contig N50 på 7,38 kbp (Zhang och Ming, opublicerade data).
AP85-441 BAC-bibliotekssekvenserna BLASTsökte mot sorghumgenomet med ett E-värde av 1e -4. Sekvenserna som hade enstaka BLAST-träffar i sorghumgenomet valdes ut som kandidat FISH-sonder. För att identifiera BAC-kloner med lågt antal kopior från BAC-biblioteket designades sekvensspecifika primers med Primer 5.0-programvara för att möjliggöra screening av BAC-pooler med PCR specifikt. Primerlängder på 18–25 bp, Tm-värden på 55–65 ° C och nukleotidkompositioner på 40–60% cytosin och guanin valdes. En tvåstegs PCR-metod användes för att screena 3D-dimensionerna i BAC-biblioteket (Asakawa et al., 1997; Crooijmans et al., 2000) med vissa modifieringar. Varje klon från en 384-brunnars platta odlades i 80 | il Lysogeny buljong + 34 mg / ml kloramfenikol över natten vid 37 ° C i en 384-brunnars odlingsplatta. Totalt odlades åtta 384-brunnars plattor med totalt 3072 BAC-kloner. För varje 384-brunnars platta konstruerade vi först 16 rad pooler (rad A till P) och 24 kolonn pooler (kolumn 1–24) för varje 384-brunnsplatta genom att blanda lika stora kulturvolymer för varje enskild klon och blandade sedan 16 rader pooler och 24 kolonn pool tillsammans med lika stora volymer från varje rad och kolumn pool som en platta pool eller superpool. I denna studie fokuserade vi på screening av åtta 384-brunnars plattor. Således bereddes åtta superpooler för de åtta plattorna separat. Den positiva 384-brunnars plattan från de åtta plattorna identifierades och därefter screenades den positiva raden bland de 16 blandningarna. Slutligen valdes de PCR-positiva kolumnerna bland 24 kolonnblandningar. Tjugofyra PCR-reaktioner utfördes för att identifiera positiva kloner från de åtta 384-brunnars plattorna.
PCR-amplifieringar utfördes som tidigare beskrivits (Bouzidi et al., 2006). Varje reaktion inkluderade rTaq-förblandning 7,5 | il, 0,6 | il av varje primer (10 | iM), 1,0 | il bakterievätskemall, till en slutlig volym på 20 | il. Efter initial denaturering vid 95 ° C under 5 minuter utfördes 35 cykler vid 95 ° C i 30 s, 55 ° C i 30 s och 72 ° C i 1 min. PCR-produkter analyserades på en 1,5% agarosgel.
Metafaskromosomberedning
Kromosompreparering utfördes som tidigare beskrivits (Lou et al., 2010) med mindre modifieringar. Sammanfattningsvis odlades S. spontaneum-växter under växthusförhållandena för skörd av rotspetsar. Skurna rotspetsar ca 1–2 cm behandlades med 0,002 mol / l 8-hydroxikinolin vid rumstemperatur i 2-4 timmar, sköljdes i vatten i 15 minuter och fixerades i etanol: ättiksyra (3: 1) i minst 24 h vid rumstemperatur. Rotspetsarna spjälkades sedan i en enzymlösning (4% cellulosa R-10 och 2% pektolyas i 0,1 M citratbuffert) vid 37 ° C under 1 timme, tvättades med isjoniserat vatten under 30 minuter och inkuberades slutligen i etanol: ättiksyra (3: 1) under cirka 30 minuter. Objektglas bereddes enligt ”flamtorkad” -metoden (Iovene et al., 2008).
BAC-DNA-rening och probmärkning
BAC-DNA extraherades med PhasePrepTM BAC DNA-kit enligt tillverkarens manual. Renat BAC-DNA märktes med standard nick-translationreaktion, inklusive utspädd DNas I, 10 × nick-translationbuffert, DNA-polymeras I, dNTP, biotin- / digoxigenin-märkta dUTP och BAC-DNA. Blandningen inkuberades vid 15 ° C under 1,5 h. De skurna produkterna undersöktes sedan på en 1,5% agarosgel med avseende på närvaro av ett utstryk mellan 300 och 500 bp. De erhållna sonderna lagrades vid -20 ° C tills de användes.
In situ-hybridisering och detektion
Sondblandning och hybridisering: Först sondblandningen (50% avjoniserad formamid, 2 × SSC, 80 ng digoxygenin- / biotinmärkt DNA, 10% dextransulfat , > 1 | ig C ° t-100) placerades i ett 90 ° C hett block i 5 minuter och överfördes sedan omedelbart på is tills det var klart att sondas för hybridizati på. De tidigare beredda flamtorkade bilderna behandlades med 70% avjoniserad formamid, denaturerad på ett värmeblock vid 80 ° C under 1.5 min, omedelbart nedsänkt i iskall 70% etanol, 90% etanol och sedan 100% etanol vardera i 5 min och lufttorkades sedan på bänken. Slutligen tillsattes denaturerade sonder till varje bild och täcktes med 24 x 32 mm täckglas. Objektglas placerades i en fuktig kammare vid 37 ° C över natten.
Probdetektering: täckglasen avlägsnades och objektglasen tvättades vid rumstemperatur i 2 x SSC under 5 minuter, vid 42 ° C i 2 x SSC i 10 minuter och vid rumstemperatur i 1 × PBS i 5 minuter i denna sekvens. Biotinmärkta probsignaler detekterades med 2 mg / ml Alexa Fluor 488 streptavidin och digoxygeninmärkta probsignaler detekterades med 2% anti-digoxigenin-rodamin från får. Antikroppscocktailen (100 | il TNB-buffert, 1 | il Alexa Fluor 488 streptavidin, 1 | il rodamin-anti-dig-får) tillsattes till bilderna, som täcktes med 24 × 32 mm täckglas, inkuberades under 1 timme vid 37 ° C i en fuktig kammare och tvättades vid rumstemperatur i 1 × PBS tre gånger i 5 min vardera. Överskott av vätska avlägsnades och 4 ’, 6-diamidino-2-fenylindol (DAPI) (Sigma, St. Louis, MO, USA) i antifadelösningen Vectashield (Vector, Burlingame, CA, USA) tillsattes för att motfärga kromosomer. Bilder togs med ett Olympus BX63 epifluorescensmikroskop. FISH-signalbilder analyserades med hjälp av CellSens Dimension-programvaran.
Resultat
Screening BAC-kloner med låg kopia
För att screena BAC-kloner som potentiellt har lågt kopieringsnummer sekvenser i S. spontaneum-genomet, sökte vi BLAST i de sekvenserade AP85-441 BAC-biblioteken mot sorghumgenomet. Totalt 2000 BAC-sekvenser motsvarande 10 sorghum-kromosomer med god kollinearitet och som visar sekvensspecificitet screenades. AP85-441 BAC-sekvenserna 2000 maskerades av REPEATMASKER mot den högupprepade sorghum-DNA-databasen och TIGR gramineae-databasen för att filtrera upprepade sekvenser. Slutligen valdes 114 BAC: er fördelade på 10 sorghum-kromosomer för FISH-analys (kompletterande tabell 1) med 7–16 BAC på var och en av de 10 sorghum-kromosomerna (figur 1). För att screena positiva BAC-kloner designades 114 specifika primers baserat på BAC-klonsekvenserna (kompletterande tabell 2) och 49 positiva BAC-kloner screenades från BAC-biblioteken (kompletterande tabell 3).
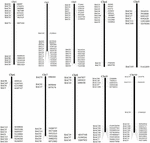
FIGUR 1. Fördelningarna av 114 BAC-kloner från AP85-441 i kromosomerna av sorghum. BAC1-114 representerar BAC-numret, data till höger är den fysiska placeringen av BAC i motsvarande region av sorghumkromosomerna. Enhet = bp.
BAC-FISH Signalstyrka och distribution
DNA-prover isolerade från de 49 positiva BAC-kloner märktes med biotin eller digoxigenin. 5S rDNA- och 45S rDNA-prober användes som kontroll och hybridiserades till S. spontaneum somatiska metafaskromosomer enligt FISH-proceduren. På grund av korrelationen mellan signalstyrka och variationen av upprepat sekvensinnehåll i BAC-sekvenserna använde vi C ° t-100 som en konkurrent (tabell 1). BAC-kloner som visar starka och stabila hybridiseringssignaler valdes för ytterligare FISH-analys.

TABELL 1. Klassificeringen av 27 positiva kloner med blockerande DNA.
Totalt 64 olika kromosomer kan observeras i metafasen av S. spontaneum. Varje BAC-FISH utfördes i fyra oberoende experiment (eller bilder). Minst 10 spridningar av somatiska metafaskromosomer analyserades i varje bild. Resultaten visade att de 27 specifika sonderna (kompletterande tabell 4) kan klassificeras i fem grupper baserat på signalen för hybridisering (tabell 1). I grupp I (inklusive BAC-18, BAC-20, BAC-29 och BAC-84) visade sonder åtta distinkta platser utan konkurrerande in situ-undertryckning (CISS) med användning av C ° t-100 (figur 2A), vilket tyder på att få upprepade sekvenser fanns i dessa BAC-sekvenser. I grupp II (inklusive BAC-2, BAC-11, BAC-14, BAC-19, BAC-31, BAC-33, BAC-43, BAC-71, BAC-73 och BAC-74), ° C -100 användes som konkurrent för BAC-probhybridisering, och sex till sju ganska distinkta platser visades i karyotyper av denna grupp (figur 2B). Hybridiseringsresultatet liknade 45S rDNA med sju signalställen, vilket kan orsakas av kromosomstrukturvariation i den homologa kromosomen. I grupp III (inklusive BAC-26, BAC-66, BAC-76 och BAC-78) användes C ° t-100 DNA som en konkurrent och åtta distinkta platser kunde observeras i karyotypen, vilket tyder på att denna grupp av BAC kloner har upprepade DNA-sekvenser (figur 2C). I grupp IV (inklusive BAC-24) observerades mer än åtta signalställen i karyotypen och uppträdde i de pericentromera och telomera regionerna (figur 2D), vilket tyder på att dessa BAC-prober hade upprepade sekvenser i S. spontaneum.I grupp V (inklusive BAC-4, BAC-5, BAC-32, BAC-34, BAC-35, BAC-69, BAC-77 och BAC-81) visade sonderna spridda signaler i alla kromosomer med begränsade regioner av enskilda kromosomer som visar specifika signaler (figur 2E). Hybridiseringsresultatet indikerade att denna grupp av BAC-kloner innehöll stora mängder repetitivt DNA i S. spontaneum, vilket kan orsakas av en snabb evolutionär divergens för de repetitiva regionerna efter uppdelningen av sorghum och S. spontaneum. Av de 49 BAC-sonderna visade därför en uppsättning av 19 BAC-sonder (kompletterande tabell 3) från grupperna I, II och III specifika signaler på S. spontaneum-kromosomer motsvarande nio av sorghum-kromosomerna bredvid Sb05. Signalerna från de andra 22 sonderna sprids i alla kromosomer. Vi valde en uppsättning av 19 BAC-sonder som S. spontaneum-kromosomspecifika signaler (figur 3). Av de 19 BAC-sonderna var en sond lokaliserad på Sb02, Sb04 och Sb09; två sonder på Sb07, Sb08 och Sb10; tre sonder på Sb01 och Sb06; och fyra sonder på Sb03. Denna sonduppsättning gav ett användbart verktyg för jämförande analys av S. spontaneum och sorghum (Tabell 2).
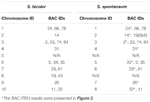
TABELL 2. Fördelningen av BAC-FISH-sonder i kromosomer av S. bicolor och S. spontaneum.
Konstruktion av ett BAC-bibliotek som är specifikt för S. spontaneum-kromosomer
Sb01 och Sb02 är de två största sorghum-kromosomerna. För att detektera genomsynten mellan sorghum och S. spontaneum valdes 10 kromosomspecifika BAC-kloner från grupperna I, II och III. Av dessa 10 BAC-sonder var tre sonder (BAC-klon-ID: 24, 66, 78) homologa med Sb01 och sju sonder (BAC-klon-ID: 14, 18, 20, 69, 71, 73, 77) motsvarade Sb02. Vi använde dubbelfärgsdetektering av FISH för kompletterande märkta BAC-par och sonderna för att kartlägga kedjens cytogenetiska förhållande för BAC-klonerna. Genom att göra detta konstruerade vi den cytogenetiska kartan över S. spontaneum baserat på de 10 BAC-sonderna.
För tre sonder motsvarande Sb01 visade FISH-analys av S. spontaneum (SES208) att BAC-24 och BAC -78-prober var huvudsakligen belägna på den distala regionen av S. spontaneum-kromosom 1, och BAC-66 kartlades i närheten av den centromera regionen (figur 4). BAC-24 och BAC-66 lokaliserade till samma kromosom (S. spontaneum-kromosom 1); samtidigt medan sond 66 och sond 78 också lokaliserades på samma kromosom, vilket visar att de tre BAC-sonderna distribuerades till samma kromosomer i S. spontaneum, vilket tyder på synten mellan S. spontaneum och sorghum för kromosom 1. FISK-resultat avslöjade att de sju BAC-sonder inriktad på Sb02; endast sonder 69, 71, 73 och 77 av de sju BAC: erna genererade intensiva signaler på en S. spontaneum-kromosom (SsChr2) (figur 5); medan sonder 14, 18 och 20 inte kunde detekteras på S. spontaneum-kromosom 2 men observerades på andra S. spontaneum-kromosomer. Dessa resultat visade att kromosomomläggningarna inträffade i motsvarande Sb02 mellan S. spontaneum och sorghum.
Dessutom delade sekvensen av BAC-2 hög likhet (97%) till ett fragment på kromosom 3 av durra. Dubbelfärgad FISH-analys visade att både BAC-2 och 45s rDNA avbildades till samma plats för S. spontaneum-kromosomen (Figur 6).
Kromosomomläggning på Sb02 mellan Sorghum och S. spontaneum
För att ytterligare undersöka kromosomomläggningen på Sb02 mellan sorghum och S. spontaneum, kromosom -specifika sonder motsvarande Sb02 (BAC-14, BAC-18 och BAC-20) och motsvarande Sb08 (BAC-19 och BAC-43) användes för FISH-analys. Resultaten visade att BAC-14 och BAC-19 var kartlagda till olika armar av samma S. spontaneum-kromosomer, vilket tyder på att kromosomomläggningar ägde rum mellan kromosomerna 2 och 8 i S. spontaneum och sorghum (Figur 7).
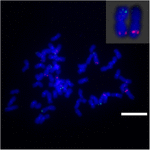
FIGUR 7. Omarrangeringen av kromosom i sockerrör och sorghum som avslöjats av FISH. BAC-14 och BAC-19 sonder märkta med biotin (grön) och digoxigenin (röd). Skalstaplar = 10 μm.
Diskussion
Saccharum är ett komplext släkte som kännetecknas av höga polyploidinivåer, med små kromosomer (Ha et al., 1999; Dhont, 2005). Att särskilja enskilda Saccharum-kromosomer baserat på deras morfologi är mycket utmanande. Genom att utnyttja sekvenser som är mycket täckta av BAC-biblioteket i S. spontaneum kunde vi screena för de potentiella BAC-klonerna med lågt antal kopior i S. spontaneum med sorghumgenomet som referens. Som en hög polyploid art kan S. spontaneum innehålla fler genomomläggningar än diploider.Skillnaderna i genomerna mellan S. spontaneum och sorghum kan vara orsaken till inexakthet i förutsägelser av BAC-sekvenser med lågt kopiaantal i S. spontaneum-genomet. I denna studie har vi inledningsvis erhållit 114 potentiella BAC-sekvenser med en kopia baserad på sorghumgenomet. Men endast 49 kunde identifieras i de partiella BAC-biblioteken, och 27 befanns vara kromosomspecifika BAC-FISH-sonder. Det finns minst två skäl att förklara dessa resultat. För det första var de 114 BAC-sekvenserna partiella fragment av BAC-insättningen på grund av begränsningarna av NGS-sekvensmontering och kan innehålla upprepade sekvenser i de andra regionerna som inte har någon sekvensinformation. Dessa potentiellt otäckta upprepade sekvenser kan vilseleda detektionen av sekvenser med låg kopia genom sekvensjämförelse. För det andra kan den senaste polyploidiseringen i S. spontaneum orsaka variationen av upprepade sekvenser mellan S. spontaneum och sorghum och därmed resultera i den ospecifika FISH-signalen i S. spontaneum. I en tidigare studie genererade sekvensering av 20 BAC i sockerrörshybrider 1,45 Mb kontigsekvenser, sekvenserna i linje med sorghumgenom spände 0,99 Mb, vilket svarade för ungefär hälften av sockerrörets BAC-sekvenser (Wang et al., 2010). Uppenbarligen existerade strykningar / insättningar mellan sorghum och Saccharum, och användningen av sorghumgenomet som referens kan inte ersätta de unika egenskaperna hos Saccharum-genomet och kan därmed orsaka oförutsedda FISH-resultat.
Vissa FISH-bilder hade starka bakgrundsbrus, vilket kan bero på små regioner med upprepade sekvenser (såsom SSR-sekvenser) i BAC-klonen, som följaktligen producerar störningar under hybridisering. Sorghumgenomet har ett upprepat innehåll på cirka 61% (Paterson et al., 2009), medan ungefär hälften av genomet består av upprepade sekvenser i Saccarrum-hybrider (De et al., 2014). I dessa upprepningsrika genom är det svårt att utveckla signalspecifika FISH-sonder, som skiljer kromosomer cytogenetiskt med liknande morfologier. CISS med blockerande DNA C ° t-100 kan effektivt utesluta upprepade sekvenser. I denna studie användes blockerande DNA C ° t-100 för FISH-analys av BAC-sonderna i grupperna II och III (figurerna 2D-F), som verifierades vara de kromosomspecifika BAC-sonderna, medan FISKEN av BAC-sonder i grupperna IV och V producerade stark bakgrundsstörning (figur 2D – F). Det är uppenbart att det finns variationer av upprepade sekvenser bland de undersökta BAC-sonderna. Därför skulle optimering av experiment vara nödvändig för BAC-FISH-analys i Saccharum. Sex till sju ställen visades i grupp II, vilket kan orsakas av de homologa kromosomstrukturvariationerna, såsom fragmentets borttagning i en eller två homologa kromosomer. I hexaploid vete hybridiserade BAC 676D4 starkare till A-genom-kromosomerna än till B- och D-genom-kromosomerna (Zhang et al., 2004). Dessa oupptäckbara av en till två signaler i de homologa kromosomerna kan också orsakas av de tekniska problemen med BAC-FISH för så många kromosomer med liten storlek.
I denna studie identifierade vi 27 kromosomspecifika BAC- FISK-sonder som motsvarar 9 av de 10 sorghum-kromosomerna (alla utom Sb05). I en studie av den genetiska kartan härrörande från en korsning mellan S. officinarum och sockerrörskultur slogs Sb05 samman med Sb06 i sockerrör (Aitken et al., 2014). I vår studie avslöjade en genetisk karta baserad på F1-populationen i S. spontaneum att Sb05 delades in i två segment och de två segmenten slogs samman med Sb06 respektive Sb07 (Zhang och Ming, opublicerade data). Nyligen visade den genetiska kartan över en medlem av Andropogoneae, Miscanthus sinensis, att Sb05 har dålig kollinearitet med motsvarande kopplingsgrupp i M. sinensis (Ma et al., 2012). På samma sätt behåller de två förfädernas majskromosomer ortologa enligt Sb05 det minsta antalet synteniska ortologer till sorghumgener (Schubert och Lysak, 2011). Därför kan frånvaron av BAC-FISH motsvarande Sb05 indikera kromosomfusion i S. spontaneum.
Sorghum och S. spontaneum divergerade för 12 miljoner år sedan (MYA), det grundläggande kromosomantalet reducerades från x = 10 till x = 8. I Aitken et al. (2014), HG2 (homolog grupp 2) av sockerrör i linje med Sb05 och Sb06, och HG8 (homolog grupp 8) till Sb02 och Sb08, vilket ger bevis för den grundläggande kromosomreduktionshändelsen (Aitken et al., 2014). I den här studien observerade vi att sorghumkromosomerna Sb02 och Sb08 hade interkromosomal omläggning i S. spontaneum, vilket framgår av bevisen för att BAC-14 var i linje med Sb02 och BAC-19 i linje med Sb08 (Figur 7). Vår studie gav de första fysiska och cytogenetiska bevisen för sorghum-inter-kromosomomläggning i S. spontaneum. Opublicerade data från vår grupp avslöjade också att Sb08 är uppdelad i två segment och slogs samman med av Sb02 och Sb09 i S. spontaneum (Zhang och Ming, opublicerade data).Sonderna motsvarande Sb09, Sb08, Sb05 och Sb06 kan vidare användas för att undersöka de interkromosomala händelserna mellan sorghum och S. spontaneum. S. spontaneum har ett brett spektrum av ploidinivåer (2n = 40–128) (Irvine, 1999). Dessa BAC-sonder kan användas för att bekräfta interkromosomal omläggning av S. spontaneum med de olika polyploidinivåerna.
På grund av olika grundläggande kromosomantal mellan sorghum (x = 10) och S. spontaneum (x = 8), var sorghum-kromosomerna inte en en-till-en-korrespondens med S. spontaneum. Som vår genetiska kartläggningsstudie nämnts här tidigare delades Sb08 upp i två segment som slogs samman med segment av Sb02 och segment av Sb09 i S. spontaneum; Sb05 delades in i två segment som slogs samman med segment av Sb06 och segment av Sb07 S. spontaneum. Därför var sonderna som motsvarade Sb08 och Sb05 inte specifika för enstaka S. spontaneum-kromosomer, medan de andra sonderna som motsvarar de andra åtta sorghum-kromosomerna kan användas som kromosomspecifika cytogenetiska BAC-FISH-sonder för S. spontaneum. De testade BAC-sonderna baserades således på de åtta sorghumkromosomerna (tabell 2) var tillräckliga för kromosomidentifiering med användning av BAC-FISH. En satellitkromosom hittades i en S. spontaneum-kromosom (kromosom 3) (Ha et al., 1999). Tidigare avslöjade samtidig FISH att signalerna från 45S rDNA lokaliserades på de sekundära sammandragningarna av satellitkromosomerna i kromosomen 3 från den anther-kultur-härledda S. spontaneum-klonen (AP85-361) (Ha et al., 1999). I denna studie kartlades BAC-2 som motsvarar Sb03 och 45s rDNA till samma plats för S. spontaneum-kromosomen, vilket ytterligare stöder tidigare resultat (Ha et al., 1999). Våra resultat gav också direkta bevis för att kromosom 3 av S. spontaneum som nämns i föregående studie är homolog med Sb03.
Slutsats
I denna studie utvecklade vi kromosomspecifika BAC: er för S spontaneum som ett steg mot utvecklingen av en enkel och reproducerbar metod för kromosomidentifiering med hjälp av BAC-FISH-cytogenetiska markörer, vilket bekräftar möjligheten att isolera kromosomspecifika BAC: er baserat på sorghumgenomet för att konstruera en fysisk karta över sockerrör. Vi ger också de första cytogenetiska bevisen på inter-kromosomal omläggning mellan sorghum och S. spontaneum. Inrättandet av BAC-FISH-teknologisystemet för sockerrör erbjuder nya möjligheter och medel för forskning om molekylär cytogenetik för sockerrör, inklusive karyotypanalys, genlokalisering och fysisk kartkonstruktion. Dessa resultat är väsentliga för montering av S. spontaneum-genom som krävs för helgenomsekvensering.
Författarbidrag
GD, JS och JZ tänkte studien och utformade experimenten. GD, JS, QZ, JW, QY, RM, KW och JZ utförde experimenten och analyserade data. GD och JZ skrev manuskriptet. Alla författare läste och godkände det slutgiltiga dokumentet.
Finansiering
Detta projekt stöddes av bidrag från 863-programmet (2013AA102604), NSFC (31201260), Program för New Century Excellent Talents in Fujian Province University och finansieringen från Fujian Agriculture and Forestry University.
Uttalande om intressekonflikter
Författarna förklarar att forskningen genomfördes i avsaknad av kommersiella eller ekonomiska relationer som kan tolkas som en potentiell intressekonflikt.
Bekräftelser
Vi tackar Dr. Xintan Zhang för att samla BAC-sekvenserna och Dr. Irene Lavagi för att redigera engelska.
Tilläggsmaterial
Dhont, A. (2005). Upptäcka genomstrukturen hos polyploider med FISH och GISH; exempel på sockerrör och banan. Cytogenet. Genome Res. 109, 27–33. doi: 10.1159 / 000082378
PubMed Abstract | CrossRef Fulltext | Google Scholar
Piperidis, G., D’Hont, A. och Hogarth, D. M. (2001). ”Kromosomkompositionsanalys av olika Saccharum interspecifika hybrider genom genom in situ (hybridisering) (GISH),” i Proceedings of the International Society of Sugar Cane Technologists, XXIV Congress (Brisbane, QLD: ASSCT), 565-566.
Google Scholar
