Charles törvénye
Jacques Charles francia fizikus (1746 – 1823) tanulmányozta a hőmérséklet hatását Charles törvénye kimondja, hogy egy adott gáztömeg térfogata közvetlenül változik a gáz abszolút hőmérsékletétől, ha a nyomást állandó értéken tartják. Az abszolút hőmérséklet a Kelvin-skálával mért hőmérséklet. A Kelvin-skálát kell használni, mert a Kelvin-skálán a nulla a molekuláris mozgás teljes leállításának felel meg.
Matematikailag Charles törvényének közvetlen kapcsolatát a következő egyenlettel lehet ábrázolni:
\
A Boyle törvényhez hasonlóan a \ (k \) is csak egy adott gázminta esetén állandó. Az alábbi táblázat a beállított állandó gázmennyiség hőmérsékletének és térfogatának adatait mutatja. A harmadik oszlop az adott adatkészlet állandója, és mindig megegyezik a térfogat és a Kelvin hőmérséklet hányadosával.
Ha ezeket az adatokat ábrázoljuk, az eredmény egyenes vonal, amely közvetlen összefüggést jelez, ábra mutatja.
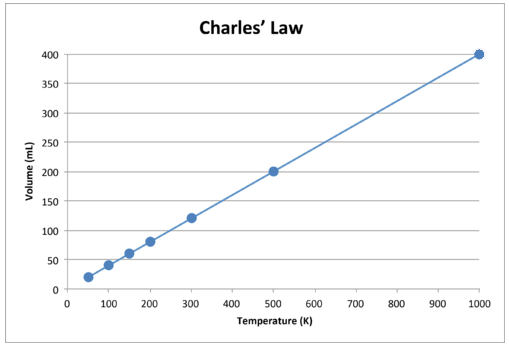
ábra (\ \ \ PageIndex {2} \): A gáz térfogata növekszik a Kelvin-hőmérséklet emelkedik.
Vegyük észre, hogy az egyenes pontosan az origó felé halad, vagyis amikor a gáz abszolút hőmérséklete megközelíti a nullát, annak térfogata is megközelíti a nullát. Ha azonban egy gáz rendkívül hideg hőmérsékletre kerül, akkor molekulái folyékony állapotba kondenzálódnak, mielőtt elérnék az abszolút nullát. Az a hőmérséklet, amelyen ez a folyékony állapotba történő változás bekövetkezik, különböző gázok esetén változó.
\
Ez az egyenlet a négy mennyiség bármelyikének kiszámítására használható, ha a másik három ismert . A közvetlen kapcsolat csak akkor áll fenn, ha a hőmérsékletet Kelvinben adják meg. A Celsius-hőmérséklet nem fog működni. Emlékezzünk a \ (\ text {K} = \: ^ \ text {o} \ text {C} + 273 \) kapcsolatra.
