Charles’s Law
Fransk fysiker Jacques Charles (1746 – 1823) studerte effekten av temperatur på volumet av en gass ved konstant trykk. Charles lov sier at volumet til en gitt gassmasse varierer direkte med gassens absolutte temperatur når trykket holdes konstant. Den absolutte temperaturen er temperatur målt med Kelvin-skalaen. Kelvin-skalaen må brukes fordi null på Kelvin-skalaen tilsvarer en fullstendig stopp av molekylær bevegelse.
Matematisk kan det direkte forholdet til Charles’s Law representeres av følgende ligning:
\
Som med Boyles lov, er \ (k \) konstant bare for en gitt gassprøve. Tabellen nedenfor viser temperatur- og volumdata for en angitt mengde gass ved et konstant trykk. Den tredje kolonnen er konstanten for dette bestemte datasettet og er alltid lik volumet delt på Kelvin-temperaturen.
Når disse dataene er tegnet, er resultatet en rett linje som indikerer et direkte forhold, vist i figuren nedenfor.
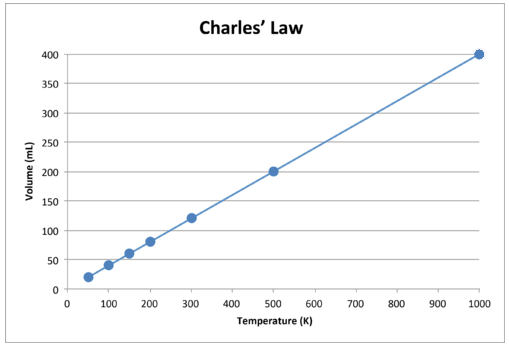
Figur \ (\ PageIndex {2} \): Volumet til en gass øker når Kelvin-temperaturen øker.
Legg merke til at linjen går nøyaktig mot opprinnelsen, noe som betyr at når den absolutte temperaturen på gassen nærmer seg null, når dens volum null. Imidlertid, når en gass bringes til ekstremt kalde temperaturer, vil molekylene til slutt kondensere til flytende tilstand før de når absolutt null. Temperaturen der denne endringen i flytende tilstand forekommer varierer for forskjellige gasser.
\
Denne ligningen kan brukes til å beregne hvilken som helst av de fire størrelsene hvis de andre tre er kjent . Det direkte forholdet vil bare gjelde hvis temperaturene er uttrykt i Kelvin. Temperaturer i Celsius vil ikke fungere. Husk forholdet som \ (\ text {K} = \: ^ \ text {o} \ text {C} + 273 \).
