Prawo Charlesa
Francuski fizyk Jacques Charles (1746-1823) badał wpływ temperatury na objętość gazu przy stałym ciśnieniu. Zgodnie z prawem Charlesa objętość danej masy gazu zmienia się bezpośrednio wraz z temperaturą bezwzględną gazu, gdy ciśnienie jest utrzymywane na stałym poziomie. Temperatura bezwzględna to temperatura mierzona w skali Kelvina. Należy użyć skali Kelvina, ponieważ zero w skali Kelvina odpowiada całkowitemu zatrzymaniu ruchu cząsteczek.
Matematycznie, bezpośredni związek prawa Charlesa można przedstawić następującym równaniem:
\
Podobnie jak w przypadku prawa Boyle’a, \ (k \) jest stałe tylko dla danej próbki gazu. Poniższa tabela przedstawia dane dotyczące temperatury i objętości dla określonej ilości gazu przy stałym ciśnieniu. Trzecia kolumna jest stałą dla tego konkretnego zestawu danych i jest zawsze równa objętości podzielonej przez temperaturę Kelvina.
Gdy dane te są przedstawione na wykresie, wynik jest linią prostą wskazującą na bezpośredni związek, pokazano na poniższym rysunku.
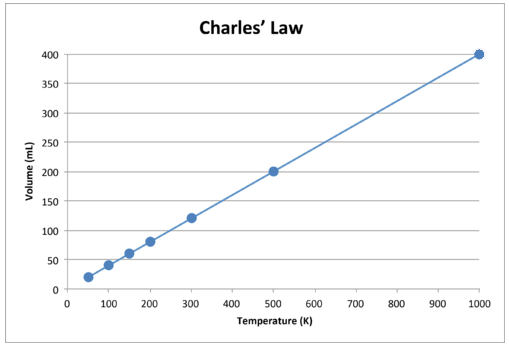
Rysunek \ (\ PageIndex {2} \): Objętość gazu rośnie wraz z temperatura Kelvina wzrasta.
Zauważ, że linia biegnie dokładnie w kierunku początku, co oznacza, że gdy temperatura bezwzględna gazu zbliża się do zera, jego objętość zbliża się do zera. Jednak gdy gaz zostanie doprowadzony do skrajnie niskich temperatur, jego cząsteczki ostatecznie skroplą się do stanu ciekłego, zanim osiągną absolutne zero. Temperatura, w której zachodzi ta zmiana w stan ciekły, jest różna dla różnych gazów.
\
To równanie można wykorzystać do obliczenia dowolnej z czterech wielkości, jeśli pozostałe trzy są znane . Bezpośrednia zależność będzie się utrzymywać tylko wtedy, gdy temperatury będą wyrażone w kelwinach. Temperatury w stopniach Celsjusza nie będą działać. Przypomnij sobie zależność, która \ (\ text {K} = \: ^ \ text {o} \ text {C} + 273 \).
