Lei de Charles
O físico francês Jacques Charles (1746 – 1823) estudou o efeito da temperatura sobre o volume de um gás a pressão constante. A Lei de Charles afirma que o volume de uma dada massa de gás varia diretamente com a temperatura absoluta do gás quando a pressão é mantida constante. A temperatura absoluta é a temperatura medida com a escala Kelvin. A escala Kelvin deve ser usada porque zero na escala Kelvin corresponde a uma parada completa do movimento molecular.
Matematicamente, a relação direta da Lei de Charles pode ser representada pela seguinte equação:
\
Como na Lei de Boyle, \ (k \) é constante apenas para uma dada amostra de gás. A tabela abaixo mostra os dados de temperatura e volume para uma determinada quantidade de gás a uma pressão constante. A terceira coluna é a constante para este conjunto de dados específico e é sempre igual ao volume dividido pela temperatura Kelvin.
Quando esses dados são representados graficamente, o resultado é uma linha reta, indicativo de uma relação direta, mostrado na figura abaixo.
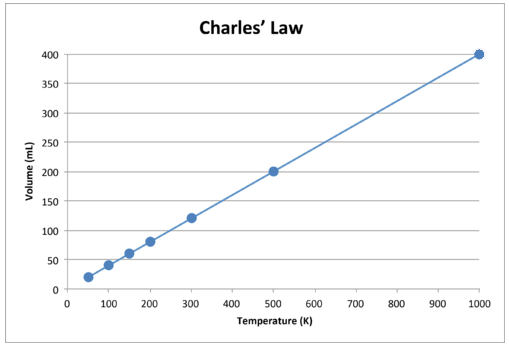
Figura \ (\ PageIndex {2} \): O volume de um gás aumenta conforme a temperatura Kelvin aumenta.
Observe que a linha segue exatamente em direção à origem, o que significa que, conforme a temperatura absoluta do gás se aproxima de zero, seu volume se aproxima de zero. No entanto, quando um gás é levado a temperaturas extremamente baixas, suas moléculas eventualmente se condensam no estado líquido antes de atingir o zero absoluto. A temperatura na qual essa mudança para o estado líquido ocorre varia para diferentes gases.
\
Esta equação pode ser usada para calcular qualquer uma das quatro quantidades se as outras três forem conhecidas . A relação direta só se manterá se as temperaturas forem expressas em Kelvin. As temperaturas em Celsius não funcionam. Lembre-se da relação que \ (\ text {K} = \: ^ \ text {o} \ text {C} + 273 \).
