Charlesin laki
Ranskalainen fyysikko Jacques Charles (1746 – 1823) tutki lämpötilan vaikutusta Charlesin laissa todetaan, että tietyn kaasumassan tilavuus vaihtelee suoraan kaasun absoluuttisen lämpötilan kanssa, kun paine pidetään vakiona. Absoluuttinen lämpötila on lämpötila, joka mitataan Kelvin-asteikolla. Kelvin-asteikkoa on käytettävä, koska nolla Kelvin-asteikolla vastaa molekyyliliikkeen täydellistä pysähtymistä.
Matemaattisesti Charlesin lain suora suhde voidaan esittää seuraavalla yhtälöllä:
\
Kuten Boylen laissa, \ (k \) on vakio vain tietylle kaasunäytteelle. Seuraavassa taulukossa esitetään lämpötilan ja tilavuuden tiedot asetetulle kaasumäärälle vakiopaineessa. Kolmas sarake on vakio tälle tietylle joukolle ja on aina yhtä suuri kuin tilavuus jaettuna Kelvin-lämpötilalla.
Kun nämä tiedot piirretään graafisesti, tulos on suora viiva, joka osoittaa suoran suhteen, näkyy alla olevassa kuvassa.
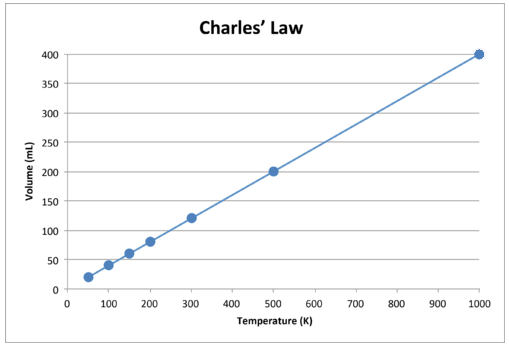
Kuva \ (\ PageIndex {2} \): Kaasun tilavuus kasvaa Kelvinin lämpötila nousee.
Huomaa, että viiva menee täsmälleen kohti alkuperää, mikä tarkoittaa, että kun kaasun absoluuttinen lämpötila lähestyy nollaa, sen tilavuus lähestyy nollaa. Kuitenkin, kun kaasu saatetaan erittäin kylmiin lämpötiloihin, sen molekyylit tiivistyvät lopulta nestemäiseen tilaan ennen absoluuttisen nollan saavuttamista. Lämpötila, jossa tämä muutos nestetilaan tapahtuu, vaihtelee eri kaasujen kohdalla.
\
Tätä yhtälöä voidaan käyttää minkä tahansa neljän määrän laskemiseen, jos muut kolme tiedetään. . Suora suhde on voimassa vain, jos lämpötilat ilmaistaan kelvineinä. Lämpötilat celsiusasteina eivät toimi. Muista suhde, joka \ (\ text {K} = \: ^ \ text {o} \ text {C} + 273 \).
